下列说法正确的是( )
| A.水的离子积常数Kw随温度改变而改变,随外加酸碱浓度改变而改变 |
| B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大 |
| C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变 |
| D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
有关化学用语正确的是
| A.溴乙烷的分子式C2H5Br | B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式 |
D.乙烯的最简式C2H4 |
1828年德国化学家维勒从无机物制得了有机物,打破了只能从有机物取得有机物的学说,这种有机物是
| A.纤维素 | B.树脂 | C.橡胶 | D.尿素 |
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为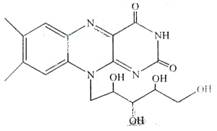
已知: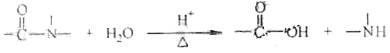
有关核黄素的下列说法中,不正确的是
| A.该化合物的分子式为C17H22N4O6 |
| B.酸性条件下加热水解,有CO2生成 |
| C.酸性条件下加热水解,所得溶液加碱后有NH3生成 |
| D.能发生酯化反应 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+H2SO4=SO2+O2+2H2O |
| D.2Fe2++Cl2=2Fe3++2 Cl - |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
| A.K+可能存在 | B.100 mL溶液中含0.01 mol CO32- |
| C.Cl-可能存在 | D.Ba2+一定不存在,Mg2+可能存在 |