用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2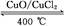 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
Ⅱ.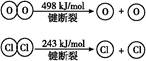
判断下列说法正确的是( )
| A.反应A的ΔH>-115.6 kJ/mol |
| B.断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ |
| C.H2O中H—O键比HCl中H—Cl键弱 |
| D.由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
下列对进行焰色反应的实验操作注意事项的说法正确的是
①钾的火焰颜色要透过蓝色钴玻璃观察 ②先灼烧铂丝到火焰无色时再蘸被检物质 ③每次实验后都要将铂丝蘸盐酸后灼烧至火焰无色为止 ④实验时最好选择本身颜色较深的火焰 ⑤没有铂丝可用光洁无锈铁丝代替
| A.仅③不正确 | B.仅④不正确 | C.③④不正确 | D.全部正确 |
氯化溴是由两种卤素互相结合而成的卤素互化物,其化学性质与Cl2的相似,
能与金属和非金属反应生成卤化物,也能与水反应:BrCl+H2O====HCl+HBrO,下列有关BrCl的性质的叙述中不正确的是
| A.有较强的氧化性 |
| B.沸点介于Br2与Cl2之间 |
| C.能使润湿的淀粉碘化钾试剂变蓝 |
| D.BrCl与水反应中既是氧化剂,又是还原剂 |
能用来鉴别NaHCO3和Na2CO3的两种白色固体的方法是
| A.分别溶于水中,观察溶解速率 |
| B.分别取少量加入到石灰水中,观察有无沉淀 |
| C.分别取少量溶于水中,逐渐滴入盐酸至过量,观察产生气体的先后 |
| D.分别取少量溶于水中,滴入氯化钙溶液,观察有无沉淀生成 |
实验室制取氯气,常用排饱和食盐水的方法收集,原因是
| A.可产生更多的氯气 |
| B.只有饱和食盐水才能除去HCl杂质 |
| C.既能除去HCl,又能防止Cl2的溶解 |
| D.食盐水易得到 |
随着核电荷数的递增,卤族元素性质递变正确的是
①单质颜色加深 ②单质沸点升高 ③单质氧化性增强 ④离子半径增大 ⑤气态氢化物稳定性增强 ⑥卤化氢水溶液的酸性增强
| A.①②③ | B.④⑤⑥ | C.①②④⑥ | D.①②③④⑤⑥ |