下表是三种难溶金属硫化物的溶度积常数(25 ℃)。
| 化学式 |
FeS |
CuS |
MnS |
| 溶度积 |
6.3×10-18 |
1.3×10-36 |
2.5×10-13 |
下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于MnS的溶解度
B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )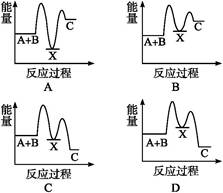
从如图所示的某气体反应的能量变化分析,以下判断错误的是( )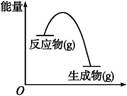
| A.这是一个放热反应 |
| B.该反应可能需要加热 |
| C.生成物的总能量低于反应物的总能量 |
| D.反应物比生成物更稳定 |
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g) CO2(g) ΔH1
CO2(g) ΔH1
C(s)+O2(g) CO(g) ΔH2
CO(g) ΔH2
②S(s)+O2(g) SO2(g) ΔH3
SO2(g) ΔH3
S(g)+O2(g) SO2(g) ΔH4
SO2(g) ΔH4
③H2(g)+O2(g) H2O(l) ΔH5
H2O(l) ΔH5
2H2(g)+O2(g) 2H2O(l) ΔH6
2H2O(l) ΔH6
④CaCO3(s) CaO(s)+CO2(g) ΔH7
CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l) Ca(OH)2(s) ΔH8
Ca(OH)2(s) ΔH8
| A.① | B.④ | C.②③④ | D.①②③ |
热化学方程式C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )
| A.碳和水反应吸收131.3 kJ能量 |
| B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量 |
| C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量 |
| D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ |
X、Y、Z、W有如图所示的转化关系,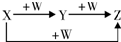 ,则X、W可能是( )
,则X、W可能是( )
①C、O2②Fe、HNO3③S、O2.
A.①② B.①③ C.②③ D.①②③