(届南京市高淳区第一学期期末试题)某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
| 次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀盐酸质量 /g |
25 |
25 |
25 |
25 |
| 反应后烧杯中物质的总质量 /g |
m |
58.4 |
82.6 |
107.6 |
求:(1)生成二氧化碳的总质量是 g。
(2)第1次加入稀盐酸充分反应后,烧杯中物质的总质量是 g。
(3)该石灰石样品中碳酸钙的质量分数。(写出计算过程)
|
"黄铜"是铜锌合金,比纯铜耐腐蚀,街头许多"金色"饰品就是用它来制作的。现取某种黄铜10g投入到154.7g某浓度稀硫酸中,恰好完全反应后生成的溶液和残余固体总质量为164.5g,计算:
(1)产生氢气的质量是多少克?
(2)这种黄铜中铜的质量是多少克?
(3)所得溶液的溶质质量分数是多少?
为了测定某生理盐水的溶质质量分数,实验过程和有关实验数据如图所示: 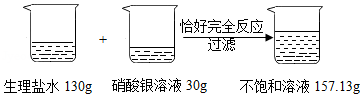
计算:
(1)反应后生成氯化银的质量是 g。
(2)该生理盐水的溶质质量分数是多少?
(化学方程式:NaCl+AgNO 3═AgCl↓+NaNO 3)
有一不纯的氯化钠固体样品(杂质不溶于水),取样品25克放入烧杯中,然后加入80克水使其充分溶解,静置后过滤取58.5克滤液,加入126.2克硝酸银溶液恰好完全反应生成白色沉淀,过滤后得到156克溶液。
计算:(1)生成白色沉淀的质量。
(2)58.5克滤液中溶质的质量分数。
(3)样品中氯化钠的质量分数。
将含有可溶性杂质的某氯化钠样品1.5g溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入100g一定溶质质量分数的AgNO 3溶液(杂质不与AgNO 3溶液反应).实验过程中,生成沉淀的质量与滴入AgNO 3溶液的质量关系如图所示,试计算:
(1)恰好完全反应时生成沉淀的质量是 .
(2)样品中氯化钠的质量是多少?
(3)原硝酸银溶液中溶质质量分数是多少?

将100g氯化钾样品(含有碳酸钾杂质)加入到50g盐酸中,样品完全反应,产生的气体全部逸出,并测得反应后的溶液总质量为145.6g。请计算:
(1)K 2CO 3中K、C、O元素的质量比为 。
(2)产生气体的质量为 g;
(3)样品中氯化钾的质量分数。(写出计算过程,最后结果精确到0.1%)