室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
温度和浓度均相同的下列溶液:①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4Cl、⑤NaClO⑥CH3COONa,它们的pH值由小到大的排列顺序是()
| A.③①②④⑤⑥ | B.⑤⑥②④①③ | C.③①④②⑥⑤ | D.③①⑥④②⑤ |
25℃时,水的电离达到平衡:H2O H++OH- △H>0,下列叙述正确的是()
H++OH- △H>0,下列叙述正确的是()
| A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| B.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| C.向水中加入固体硫酸铜,平衡逆向移动,c(OH-)减小 |
| D.将水加热,KW增大,pH不变 |
2 molA与2 molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)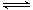 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是()
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是()
A.z=2
B.2s后,容器内的压强是初始的7/8倍
C.2s时C的体积分数为2/7
D.2s后,B的浓度为0.5mol/L
下列事实能用勒夏特列原理解释的是()
A.FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B.工业合成氨中,将氨气液化分离
C.A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D.对于反应2NO2(g) N2O4(g)△H<0,升高温度可使体系颜色变深
N2O4(g)△H<0,升高温度可使体系颜色变深
将浓度为0.1mol·L-1Al2(SO4)3溶液加水稀释,下列结论错误的是()
| A.水解平衡正向移动 | B.各微粒浓度均变小 |
| C.溶液中离子数目增多 | D.c(Al3+)与c(SO42-)的比值减小 |