I.目前,我国采用“接触法”制硫酸,设备如图所示: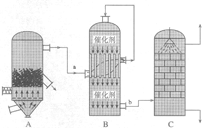
(1)图中设备A的名称是_____________,该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是_____(填字母序号)。
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% |
| D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为 H2SO4时放出的热量
II.纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源于 。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) 。
(5)写出“联合制碱法”有关反应的化学方程式: 。
[化学—选修2:化学与技术]银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
(1)熔炼时被氧化的元素是,酸浸时反应的离子方程式为。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是。
(2)操作a是,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+Al2O3 +↑。
+↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,则V至少为L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+ Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差g。
电解法促进橄榄石(主要成分是Mg2SiO4)固定CO2的部分工艺流程如下:
已知:Mg2SiO4(s) +4HCl(aq) 2MgCl2(aq) +SiO2 (s) + 2H2O(l)△H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l)△H =-49.04 kJ·mol-1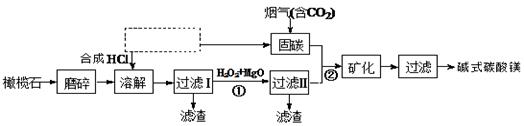
(1)橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为。
(2)上图虚框内需要补充一步工业生产的名称为。
(3)下列物质中也可用作“固碳”的是。(填字母)
a.CaCl2b.H2NCH2COONac.(NH4)2CO3
(4)由下图可知,90℃后曲线A溶解效率下降,分析其原因。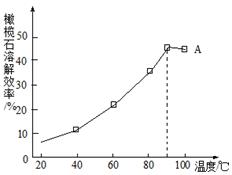
(5)过滤Ⅰ所得滤液中含有Fe2+,检验该离子方法为。
(6)过程①为除去滤液中的杂质,写出该除杂过程所涉及反应的离子方程式
、。
PM2.5污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX。
(1)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量,写出该反应的热化学方程式。若起始时向密闭容器内充入0.4molSO2和0.2mol O2,达平衡后放出的热量为Q,则Q39.32kJ(填“>”、“<”或“=”).
(2)一定条件下,在恒容密闭的容器中,当上述反应达到平衡时,下列说法正确的是__________(填序号)
a.2v逆(SO2)=v正(O2)
b.ΔH保持不变
c.混合气体密度保持不变
d.混合气体的平均相对分子质量保持不变
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和1 mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同,),充分反应均达到平衡后,两容器中SO2的转化率关系是I_________II(填“>”、“<”或“=”)。若测得容器II中的压强减小了30%,则该容器中SO3体积分数为(结果保留3位有效数字)。
(4)将生成的SO3溶于水,再向溶液中通入NH3得到1L cmol/L(NH4)2SO4溶液的PH=5,计算该(NH4)2SO4溶液的水解平衡常数Kh=。
(5)NO2、O2和熔融NaNO3可制作原电池,其装置见下图。该电池中Na+向_____电极移动(填“Ⅰ”或“Ⅱ”),在电池使用过程中石墨I电极上生成氧化物Y,其电极反应为。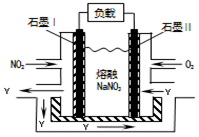
(1)已知:①CO(g)+2H2(g) CH3OH(g)△Hl= -91kJ·mol-l
CH3OH(g)△Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2= -24 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2= -24 kJ·mol-1
③CO(g) +H2O(g)  CO2(g)+H2(g)△H3= -41 kJ·mol-l
CO2(g)+H2(g)△H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=
CH3OCH3(g) +CO2(g)△H=
化学平衡常数K=(用含K1、K2、K3的代数式表示)。
(2)写出反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)平衡常数的表达式Kc=
CH3OCH3(g)+H2O(g)平衡常数的表达式Kc=
若在某温度下的平衡常数Kc = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c /mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
某二元酸 H2A 的电离方程式是:H2A=H++HA-,HA-  A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是(填“强电解质”或“弱电解质”或“非电解质”)
(2)NaHA 溶液显(填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示);
(3)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能0.11mol·L(填“<”、“>”或“=”);
(4)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是。