如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。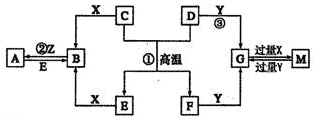
(1)写出X的电子式: 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式: 。
(4)写出反应③的离子方程式: 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别 (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明 。
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为个.
(2)
分子内的
键、分子间的范德华力和氢键从强到弱依次为。 沸点比
沸点比 高,原因是.
高,原因是.
(3)
可与
形成
,
中
原子采用杂化。
中
键角比
中
键角大,原因为。
(4)
与
的晶胞同为面心立方结构,已知
晶体密度为ag cm-3,
表示阿伏加德罗常数,则
晶胞体积为Cm3。
cm-3,
表示阿伏加德罗常数,则
晶胞体积为Cm3。
水处理技术在生产、生活中应用广泛。
(1)含有较多离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为写出一个即可)。
(2)将
型阳离子交换树脂和
型阴离子交换树脂串接来软化天然硬水,应先使硬水通过(填"
"或"
")型离子交换树脂,原因是。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为。电渗析法净化水时,使离子通过半透膜的推动力是。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的。
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为。要清洗附着在试管壁上的硫,可用的试剂是。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320
左右,电池反应为
,正极的电极反应式为。
(由
和
制得)的两个作用是。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的倍。
(3) 溶液中离子浓度由大到小的顺序为,向该溶液中加入少量固体 ,溶液 (填"增大""减小"或"不变"), 溶液长期放置有硫析出,原因为(用离子方程式表示)。
研究
、
、
等大气污染气体的处理具有重要意义。
(1)
可用水吸收,相应的化学反应方程式为。利用反应
 也可处理
。当转移1.2
电子时,消耗的
在标准状况下是L。
也可处理
。当转移1.2
电子时,消耗的
在标准状况下是L。
(2)已知:

 则反应
则反应
 的
。
的
。
一定条件下,将
与
以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.
和
的体积比保持不变
d.每消耗1
的同时生成1
测得上述反应平衡时
与
体积比为1:6,则平衡常数K=。
(3)
可用于合成甲醇,反应方程式为
 。
。
在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填">"或" <")。实际生产条件控制在250℃、1.3×104
左右,选择此压强的理由是。

白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
已知:
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是_。
(2)
的反应类型是;
的反应类型是。
(3)化合物
不与
溶液发生显色反应,能与
反应放出
,推测其核磁共振氢谱(
)中显示有种不同化学环境的氢原子,其个数比为。
(4)写出
反应的化学方程式
(5)写出化合物
、
的结构简式:
,
。
(6)化合物 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:。
①能发生银镜反应;②含苯环县苯环上只有两种不同化学环境的氢原子。