丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g) △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H = -566 kJ/mol
③H2O(l) = H2O(g) △H =" +" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
该反应的平衡常数与温度的关系如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| |
H2O |
CO |
CO2 |
H2 |
| 甲 (质量/g) |
1.8 |
8.4 |
a |
1 |
| 乙 (质量/g) |
1.8 |
2.8 |
0 |
0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是 ;达到平衡
时,乙容器中CO的转化率为 。
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。
(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是(填序号).
(2)①是______________(填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________。
F1的结构简式是________________。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________。
已知某烃类化合物A的相对分子质量为84:
(1)若分子中含有一个碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
A中的碳原子是否都处于同一平面?(填“是”或者“不是”)。
(2)若分子中无碳碳双键,且分子中只有一种类型的氢原子
A的结构简式为
其名称为
请根据官能团的不同对下列有机物进行分类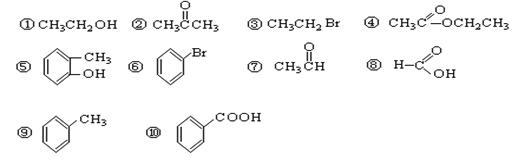
(1)芳香烃: ;(2)卤代烃:;
(3)醇: ;(4)酚: ;(5)醛: ;
(6)酮: ;(7)羧酸: ;(8)酯:。
(Ⅱ)
⑴键线式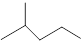 表示的分子式。
表示的分子式。
⑵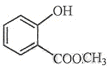 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶书写该物质的名称: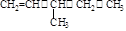
今有分子量为58的几种有机物,试推断符合条件的有机物的分子式或结构简式
(1)若该有机物为烃,则分子式为,其中带有支链的同分异构体在核磁共振氢谱图中有个吸收峰
(2)若该有机物是一种饱和一元脂肪醛,则其与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则其结构简式为,(注羟基连在双键上的有机物极不稳定)该物质生成高分子化合物的化学方程式为。
选用适当的试剂和方法除去下列物质中的杂质(括号内)填下表:
除杂质的试剂:①氢氧化钠溶液②溴水③生石灰④饱和碳酸钠溶液
除杂质的方法:A分液 B萃取 C蒸馏 D过滤
| 混合物 |
除杂质的试剂 |
除杂质的方法 |
| 苯(苯酚) |
(1) |
(4) |
| 酒精(水) |
(2) |
(5) |
| 乙酸乙酯(乙酸) |
(3) |
(6) |