“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。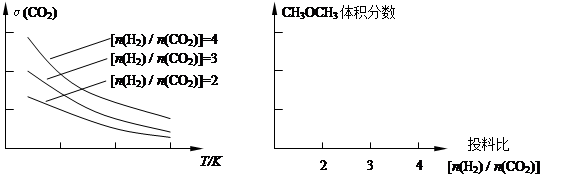
②某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;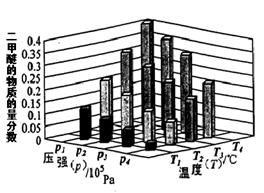
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
A. 正反应速率先增大后减小
B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大
D. 反应物的体积百分含量增大
E. 混合气体的密度减小
F. 氢气的转化率减小
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式__ 。以此燃料电池作为外接电源按图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变b.气体的密度不随时间改变
c. c(A)不随时间改变d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。
(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g) 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
| 物质 |
M |
N |
P |
Q |
| 起始投料/mol |
2 |
1 |
2 |
0 |
已知:①不饱和碳上的氢可与1,3-丁二烯发生1,4加成。如: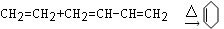
②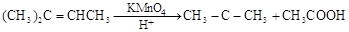
聚-3-羟基丁酸酯(PHB),可用于制造可降解塑料等,它由3-羟基丁酸[CH3CH(OH)CH2COOH]分子聚合而成。合成聚-3-羟基丁酸酯的途径很多,其中有一种途径的副产物少、污染小、原子利用率高,其合成路线如下: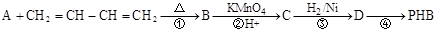
试回答下列问题:
(1)下列关于CH2=CH—CH=CH2的叙述中,正确的是()
A.CH2=CH—CH=CH2可以通过加聚反应合成天然橡胶
B.CH2=CH—CH=CH2中的原子可能在同一平面上
C.CH2=CH—CH=CH2可以一步合成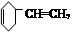
D.CH2=CH—CH=CH2能与溴水、酸性高锰酸钾发生加成反应而使之褪色
(2)上述转化过程中属于加成反应的是_______________(填序号)。
(3)反应②符合绿色化学思想(原料中碳原子100%转化成产物,不产生副产物),则A的结构简式为_______________________________。
(4)写出反应④的化学方程式____________________________________________________。
(5)写出两种能发生银镜反应,且能与氢氧化钠溶液发生水解反应的C的同分异构体的结构简式。_________________、_________________。
(6)为研究物质的芳香性,可将CH ≡ C—CH3三聚得到苯的同系物,写出产物可能的结构简式。
______________________________________________________。
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
(1)A中含有的官能团名称为,C转化为D的反应类型是。
(2)1mol E最多可与mol H2反应;写出D与足量NaOH溶液完全反应的化学方程式:。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式。
A.能够发生银镜反应,也能发生水解反应
B.分子内只含四种不同化学环境氢原子
C.能与FeCl3溶液发生显色反应
(4)若将D与过量NaOH溶液加热充分反应后再蒸干、灼烧,最后容器中残留的固体物质为。
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下: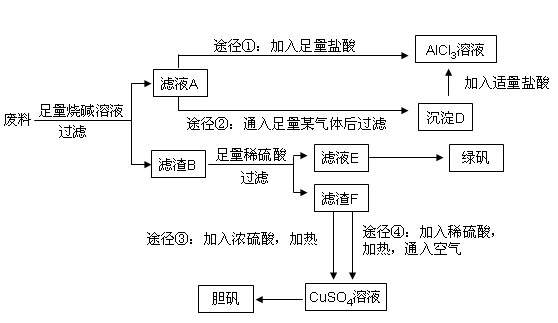
(1)写出合金与烧碱溶液反应的离子方程式:。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式。你认为较合理的途径是(填①或②),理由是:。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了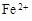 和
和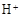 外,还可能存在(用离子符号表示),检测该离子的方法是。
外,还可能存在(用离子符号表示),检测该离子的方法是。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:、。
(5)途径④发生的反应的化学方程式为:。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、、自然干燥。
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)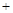 2H2(g)
2H2(g)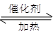 CH3OH(g)
CH3OH(g)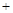 Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(1)判断反应达到平衡状态的依据是()
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q0 (填“>”、“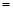 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是()
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c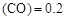 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v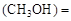 mol /(L·min),
mol /(L·min),
CO的转化率为。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)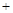 CO2(g)
CO2(g)  2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)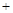 H2O(g)
H2O(g)  CO(g)
CO(g)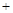 H2(g)平衡常数K2
H2(g)平衡常数K2
CO(g)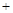 H2O(g)
H2O(g)  H2(g)
H2(g)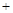 CO2(g)平衡常数K3
CO2(g)平衡常数K3
则K1、K2、K3之间的关系是:。