化合物C是一种合成药品的中间体,其合成路线为:

已知: 
(1)写出 中官能团的名称 。
中官能团的名称 。
(2)写出反应①的化学方程式 。
(3)反应②属于 反应(填有机反应类型)。
(4)D是比 多一个碳的同系物,则满足下列条件的D的同分异构体共有 种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式 。
多一个碳的同系物,则满足下列条件的D的同分异构体共有 种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式 。
①显弱碱性,易被氧化;②分子内含有苯环;③能发生水解反应
(5)请你设计由A合成B的合成路线。提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下: 。
。
写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)__________________________________
(2)碳酸钠溶液与盐酸混合________________________________________
(3)硫酸铜溶液和氢氧化钡溶液混合_____________________________________
(4)向足量澄清石灰水中通入二氧化碳_______________________________________
(6分) A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
。
(3)将BA4,D2分别通入插在酸溶液中的两个电极形成燃料电池,则通BA4的一极的电极反应式为。
(4)化学反应3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),右图 表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为,平衡时压强为起始压强的倍。
表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是。温度为T℃时,将4amolA2和2a molC2放人1L密闭容器中,充分反应后测得C2的转化率为50%,则平衡混合气中C2的体积分数为,平衡时压强为起始压强的倍。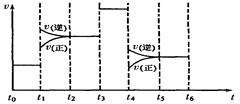
(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
①B中Sn极的电极反应式为__________________,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)__________。
②A中总反应离子方程式为__________。比较A、B、C中铁被腐蚀的速率,由快到慢 的顺序是________。
的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题: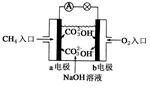
①电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。
②电池工作一过程中正极pH______,负极pH值_______,一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
已知某溶液中只存在OH-、H+、NH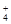 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH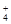 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c(NH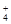 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(NH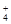 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH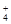 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_____________;若上述关系中④是正确的,则溶液中的溶质为____ ___。
(3)上述关系②是否正确:____________(填正确或不正确),_________________(正确则指明溶质,不正确 则说明原因)
则说明原因)
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)_______c(OH-)。
(5)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填图像符号)________________;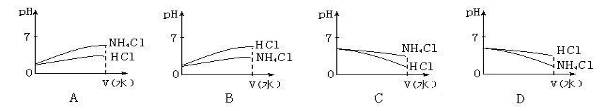
有均为1 mol/L的Na2CO3、FeCl3溶液,在Na2CO3溶液中滴入酚酞,则溶液呈现________(填“浅红”或“红色”,原因:__________________________(用离子方程表达),加热,则颜色变_________(浅或深),在FeCl3溶液中滴入石蕊,,则溶液呈现________(填颜色),若将其蒸干并灼烧,则得到的固体物质为:__________________________,若将饱和的FeCl3滴入沸水,则发生的反应: _________________________(用离子方程表达)
mol/L的Na2CO3、FeCl3溶液,在Na2CO3溶液中滴入酚酞,则溶液呈现________(填“浅红”或“红色”,原因:__________________________(用离子方程表达),加热,则颜色变_________(浅或深),在FeCl3溶液中滴入石蕊,,则溶液呈现________(填颜色),若将其蒸干并灼烧,则得到的固体物质为:__________________________,若将饱和的FeCl3滴入沸水,则发生的反应: _________________________(用离子方程表达)