工业上常用Fe作电极电解处理含Cr2 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )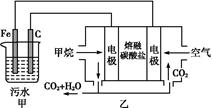
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C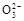 |
D.甲中阳极附近溶液中的离子反应方程式是:Cr2 +6Fe2++14H+=2Cr3++6Fe3++7H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O |
下列过程中,离子键被破坏的是
| A.干冰升华 | B.KNO3熔化 | C.NaCl溶于水 | D.HCl气体溶于水 |
下列实验事实陈述ⅠⅡ正确并且有因果关系的是
| Ⅰ操作 |
Ⅱ结论 |
|
| A |
滴加BaC12溶液生成白色沉淀 |
原溶液中有SO42— |
| B |
用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 |
原溶液中有Na+无K+ |
| C |
滴加氯水和CC14,振荡、静置。下层溶液显紫色 |
原溶液中有I— |
| D |
滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 |
原溶液中无NH4+ |
汽车尾气里含有有毒的NO和CO,NO和CO能缓慢地反应生成N2和CO2.对此反应的下列叙述不正确的是
| A.使用催化剂能加快反应速率 | B.升高温度能加快反应速率 |
| C.改变压强对反应速率无影响 | D.此反应能减轻尾气对环境的污染 |
在一定条件下,对于在密闭容器中进行的反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
4NO(g)+6H2O(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
| A.达到化学平衡时,v正(O2)=v逆(NO) |
| B.若单位时间内生成2Mol NO的同时消耗2 Mol NH3。 |
| C.NH3、O2、NO、H2O在容器中共存 |
| D.c(NH3)保持不变 |
已知反应:X+Y = M+N为放热反应,对该反应的下列说法中正确的是
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因为该反应为放热反应,故不必加热反应就可发生 |