Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。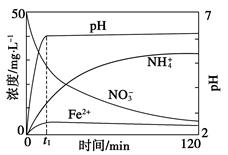
(本题有2小题,共16分,每空2分)
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________。
②工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。
③工作时,电解质溶液中阴离子移向________极。
④电流方向从________极流向________极。
(2)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题: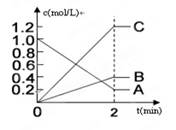
①该反应的反应物是。
②该反应的化学方程式为。
③在0-2min,该反应用A表示的平均反应速率为。
(16分,每空2分)用A+、B-、C2-、D、E、F分别表示含有10个电子的微粒,其中A、B、C是含单核的微粒,D、E、F 是分子。请回答:
(1)A是、B是、C是(用微粒符号表示) 。
(2)D是由两种元素组成的双原子分子,其化学式是。
(3)E是由两种元素组成的三原子分子,其化学式是,电子式是。
(4)F分子中含有5个原子,其化学式电子式表示它的形成过程。
(16分)根据下图,回答问题。
(1)有机物的名称: B._________ F.___________,E中所含官能团的名称_________。
(2)有机物的结构简式:C.____ ____,G.____ ____。
(3)反应D®E的化学方程式是 .
(4)A®B的反应类型属于 。
(5)写出实验室制取A的化学方程式 。
有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B式量比空气的平均式量稍小,且实验式与A相同,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的化学式。A;B。
(2)A、B中(填A或B)共有四种同分异构体,同分异构体的名称是。
(3)写出B与溴的四氯化碳溶液反应的化学方程式:。
(一)有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定量的这些烃,完全燃烧后生成m mol CO2和n mol H2O。则
(1)当m=n时,该烃是;
(2)当m=2n时,该烃是;
(3)当2m=n时,该烃是;
(4)当4m=7n时,该烃是。
(二)有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯
②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯
⑥甲烷与氯气在光照的条件下反应
⑦溴乙烷和氢氧化钠乙醇溶液共热
⑧溴乙烷+和氢氧化钠溶液共热
其中属于取代反应的是;属于氧化反应的是.;属于加成反应的是;属消去反应的是________;属于聚合反应的是______。