运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2),在25℃下,向0.1L0.002mol•L-1的NaCl溶液中逐滴加入0.1L0.002mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol•L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
人早晨不吃早餐,血糖会降低。一个人早晨吃了一个馒头,现从此人的消化道中取一些液体。
(1)对液体进行一些处理后,加入银氨溶液,在合适的条件下,产生了银镜现象,能否说明淀粉已完全水解?为什么?___________________
(2)如果反应需要1 mol银氨离子,则反应消耗了________mol葡萄糖
(1)通常所说的三大合成材料是指________、________和________。
(2)塑料的主要成分是 ,除此外还根据需要加入某些特定用途的添加剂,比如能提高塑性的________,防止塑料老化的________等。
(3)塑料制品在生产、生活中有着广泛的应用,但塑料制品在给我们的生活带来方便的同时,也存在着严重的危害环境的问题。
①由聚氯乙烯等塑料垃圾引起的污染叫________。
②塑料废弃物的危害有________。
a.难以分解,破坏土壤结构,影响植物生长 b.污染海洋 c.危及海洋生物的生存 d.造成海难事件 e.破坏环境卫生,污染地下水
| A.abcde | B.abcd | C.bcd | D.ae |
已知A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子,向试管A的溶液中滴入酚酞试液呈红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有___________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为______(填“A”或“B”)。
(3)若向试管A所含阳离子的硫酸氢盐溶液中加入Ba(OH)2溶液,使原溶液恰好成中性,写出该过程的离子方程式: 。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为_______________, 。
(5)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为 。
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石(Cu2(OH)2CO3),主要燃料是木炭,冶炼温度估计在1000 ℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的水溶性分析中,判断正确的是( )
A.前者可溶,后者难溶 B.前者难溶,后者可溶
C.两者均可溶 D.两者均难溶
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有( )
①Cu2(OH)2CO3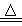 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C  2Cu+CO2↑
2Cu+CO2↑
③CuO+CO Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C 2CO
2CO
A.①② B.①③ C.①②③ D.①②③④
(3)在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)_________,不属于氧化还原反应的有___________。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式 , 。
用双线桥法分析下列反应:
(1)Fe+CuSO4=FeSO4+Cu
(2)Cl2+H2O=HClO+HCl
(3)5NH4NO3 2HNO3+4N2↑+9H2O
2HNO3+4N2↑+9H2O
(4)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O