(1)下列物质中水溶液能导电但属于非电解质的有 (填序号)①乙醇 ②氨气 ③氯气 ④氯化钠 ⑤硫酸 ⑥干冰 ⑦BaSO4 ⑧醋酸 ⑨氢氧化钠 ⑩CaO
(2)某实验需要使用240ml 0.4mol/L CuSO4溶液,用胆矾配制该浓度溶液需要使用的仪器有托盘天平、烧杯、玻璃棒、 、 ;需要称量 克胆矾;若所称胆矾失去部分结晶水,则配制出的溶液浓度 。(填偏高、偏低或无影响)
(3)汉紫是中国古代兵马俑和古代壁画中的一种颜料,其化学式是BaCuSi2O6,请用氧化物的形式表示其组成: 。
通常状况下 ,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由同种元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由同种元素R组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)。
a、同位素 b、同系物 c、同素异形体 d、同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子的结构式是: 。
。
②KCN溶液显碱性,原因是(用离子方程式表示):。
(5)工业上通过电解可制得X,过程中在(填“阴极”或“阳极”)产生X,每生成标准状况下33.6 L的X,转移的电子数目为。
置换反应的通式可表示为: 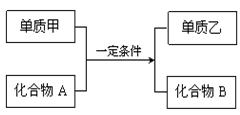
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3 Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是,A非常细,导光能力很强,可用作。
用于制作防弹背心材料的聚合物A,其结构为: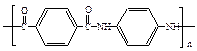 ,下列是由化合物B(分子式:C8H10)制备该聚合物的一种方案:
,下列是由化合物B(分子式:C8H10)制备该聚合物的一种方案: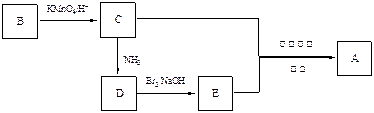
已知:
(1)写出B、D的结构简式:B、D。
(2)写出满足1H核磁共振谱的苯环上有两种氢,且能发生银镜反应的C的同分异构体(任写三个结构简式)、、。
(3)C的上述一个同分异构体F,存在下列转化:
①写出F的结构简式。
②用一个化学方程式表示由F 生成 G 和H过程中的第①步反应。
③G与C能发生缩聚反应,写出该缩聚反应的化学方程式:。
与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式为:
某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理: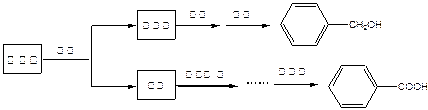
重结晶过程:溶解—→活性炭脱色—→趁热过滤—→冷却结晶—→抽滤—→洗涤—→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小。
请根据以上信息,回答下列问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是 ,其理由是。充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上下层分离的正确操作是。萃取分液后,所得水层用盐酸酸化的目的是。
,其理由是。充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上下层分离的正确操作是。萃取分液后,所得水层用盐酸酸化的目的是。
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如下图所示: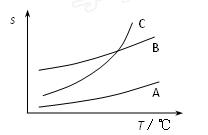
重结晶时,合适的溶剂是,其理由是。
重结晶过程中,趁热过滤的作用是。
洗涤时采用的合适洗涤剂是。
A.饱和食盐水 B.Na2CO3溶液
C.稀硫酸 D.蒸馏水
(3)为检验合成产物中苯甲酸的含量,称取试样1.220 g,溶解后在容量瓶中定容至100 mL,移取25.00 mL试样溶液,用0.1000 mol·L-1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65 mL,则试样中苯甲酸的含量。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO (g) + 2H2(g)  CH3OH (g) △H 1(反应1)
CH3OH (g) △H 1(反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: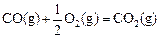 △H2=-283 kJ·mol-1(反应2)
△H2=-283 kJ·mol-1(反应2)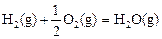 △H3=-242 kJ·mol-1(反应3)
△H3=-242 kJ·mol-1(反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C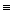 O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1=。
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+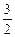 O2(g) ="=" CO2(g)+2H2O(g) △H4
O2(g) ="=" CO2(g)+2H2O(g) △H4
该反应的焓变△H4=。
与CO和H2相比,甲醇作为汽车动力燃料的优点是。
(3)反应1的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有(写出3点)。既能提高产率,又能提高反应速率的措施是。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+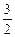 O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下: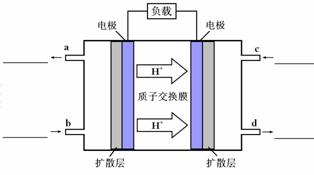
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为。