(1)某恒温恒容条件下的可逆反应:N2(g)+3H2(g) 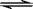 2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题:
2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题:
①A= , B= ;
② 平衡后,再充入5 molNH3,化学平衡将向 移动(填“左”或“右”或“不移动”),达新平衡时N2的百分含量 原平衡时N2的百分含量(填“大于”或“小于”或“等于”);
③平衡后若升高温度,则平衡向 方向移动;若增加压强,则平衡向
方向移动(填“向左”或“向右”)。
(2)某恒温恒压条件下的可逆反应:N2(g)+3H2(g) 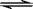 2NH3(g),起始充入1 mol N2、3 mol H2、16 mol NH3,容器的容积为V L。达到平衡后,N2、H2、NH3的物质的量分别为Amol、Bmol、c mol,此时容器的容积为1.1V L,回答下列问题:
2NH3(g),起始充入1 mol N2、3 mol H2、16 mol NH3,容器的容积为V L。达到平衡后,N2、H2、NH3的物质的量分别为Amol、Bmol、c mol,此时容器的容积为1.1V L,回答下列问题:
① 起始时反应速率V正 V逆(填“大于”或“小于”或“等于”)
② 平衡时A= ,B= 。
③ 若平衡后再充入3.6 molNH3,重新建立平衡时容器的容积为 L。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: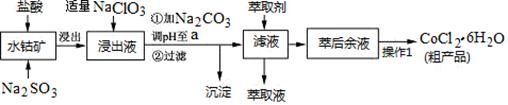
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。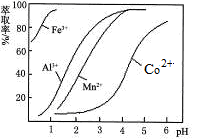
A.2.0~2.5B.3.0~3.5C.4.0~4.5D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
对-甲乙苯( )是一种重要的有机原料,用该物质可合成其他物质。
)是一种重要的有机原料,用该物质可合成其他物质。
已知:①1molD与足量钠反应可生成1mol氢气;
②D、E、F每种分子中均只含有一种含氧官能团。
③G是一种有机高分子化合物。
回答下列问题:
(1)对-甲乙苯的系统命名为_____________;A的结构简式为____________。
(2) A→B的反应类型为___________;F中含氧官能团的名称为____________。
(3)C在引发剂的作用下,可生成高分子化合物,该高分子化合物的链节为____________。
(4) 1molE和足量银氨溶液反应,生成沉淀的物质的量为___________。
(5) D+F→G的化学方程式为_____________________________________________。
(6)H比D相对分子质量小14,H的同分异构体能同时满足如下条件:①苯环上有两个取代基;②遇氯化铁溶液显紫色;③核磁共振氢谱为六组峰,且峰面积比为2:2:2:2:1:1,写出H的这种同分异构体的简式_________________。
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HA H++A- Ka(HA)=2.95×10-8
H++A- Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)=;该反应的化学方程式为________________________________________。
在有机化工生产中,下图是合成某种聚酯纤维H的流程图。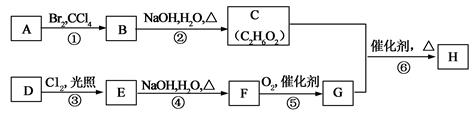
已知:A、D为烃,质谱图表明G的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧;G能与NaHCO3溶液反应且含有苯环;核磁共振氢谱表明E、G分子中均有两种类型的氢原子,且E分子中两种类型的氢原子的个数比为1∶1。
(1)①、③ 的反应类型依次为、;
(2)B的名称为:;E的结构简式为:;
(3)写出下列化学方程式:
②;
⑥;
(4)F有多种同分异构体,写出同时符合下列条件的所有同分异构体的结构简式。
a.含有苯环且苯环上只有2个取代基
b.能与NaOH溶液反应
c.在Cu催化下与O2反应的产物能发生银镜反应