柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Al3+ |
3.0 |
5.0 |
| Fe2+ |
5.8 |
8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母),原因是_________________________________
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是__________________。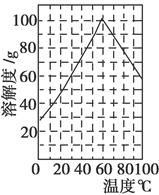
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,________,得到FeSO4溶液,________,得到FeSO4·7H2O晶体。
由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式 ,该反应的还原产物是 。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:

(1)电池中的左侧“电极”的电极名称是 (填“正极”或“负极”)。
(2)放电过程中钠离子从 (选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式 。
在容积为2L的密闭容器中,进行反应:A(g)+2B(g) C(g)+D(g)
C(g)+D(g)
在不同温度下,D的物质的量n(D)和时间t的关系如图所示。试回答下列问题:
(1)800℃时,0—5min内,以B的浓度变化
表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据
是 。
a.容器中压强不变
b.混合气体中c(A)不变
c.2v正(B)=v逆(D)
d.A、B、C、D四者共存
(3)该反应的正反应为 反应(填吸热或放热);判断的理由是 。
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程)。
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间。
| ② |
|||
| ⑦ |
⑧ |
(1)元素②在周期表中的位置为 周期 族;②、⑦、⑧三种元素的原子半径由小到大的顺序是 (用元素符号表示)。②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是 (用化学式表示)。
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式: 。
[化学——有机化学基础]
A、B、C、D四种芳香族化合物有的是药物、有的是香料。它们的结构简式如下所示:
A B C D
请回答下列问题:
(1)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有(用A、B、C、D填空)。
(2)1molA最多能与molH2发生加成反应。
(3)B分子中含有的官能团是______________(填写名称);B的同分异构体中,苯环上有两个邻位取代基,分别为“—OH”和含有“—COO—”结构的基团共有4种,其中两种(G和H)结构简式如下图所示,请补充另外两种。 、。
、。
(4)2006年齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。D是“亮菌甲素”的结构简式,它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。 “亮菌甲素” 不能发生的反应类型是。
A.取代反应 B.消去反应 C.加成反应 D.氧化反应
(5)已知:①—COOH连接在苯环上,酸性显著增强。②醇和酸在催化剂作用下可直接反应生成酯,而酚不能。酚只能跟有机酸酐作用生成酯。例如: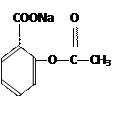

现以C为基本原料,请选择必要的其他反应物,用最佳途径合成
请写出其反应的化学方程式:
①;
②。
[化学——物质结构与性质]
(1)金属钛(22Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,写出Ti元素的基态原子电子排布式为;
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为。
(3)COCl2俗称光气,分子中C原子采取杂化成键;其中碳氧原子之间的共价键含有(填字母): a.2个σ键;b.2个π键;c.1个σ键、1个π键。
(4)①短周期某主族元素M的逐级电离能情况如下图A所示,则M元素位于周期表的第
族。
②第三周期8种元素按单质熔点高低的顺序如下图B所示,其中序号“8”代表(填元素符号);其中电负性最大的是(填图B中的序号)。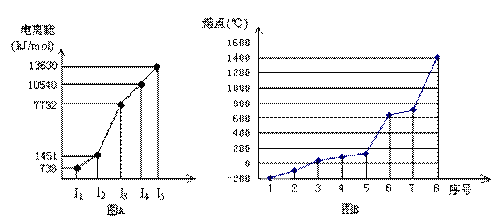
(5)由C原子跟Si原子以1 : 1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是(填化学式)试从结构角度加以解释:。
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是。