下列离子方程式书写正确的是( )
| A.用醋酸溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2气体:I2+SO2+2H2O=2I-+SO42—+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42—+Ba2++OH-=BaSO4↓+H2O |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42—+3Cl-+H2O+4H+ |
下列实验设计和结论相符的是
| A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| C.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| D.用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+ |
常温下,下列说法正确的是
| A.C(石墨,s) = C(金刚石,s);DH>0,所以石墨比金刚石稳定 |
| B.使紫色石蕊试液变红的溶液中Fe2+、Mg2+、NO3-、Cl-一定能够大量共存 |
| C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
D.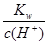 =0.1mol/L的溶液中Na+、K+、SiO32-、NO3-一定不能大量共存 =0.1mol/L的溶液中Na+、K+、SiO32-、NO3-一定不能大量共存 |
设NA表示阿伏加德罗常数的值,下列叙述错误的是
A.在18g 中含有 中含有 个氧原子 个氧原子 |
| B.在反应KIO3+6HI =KI +3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
| D.25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA |
下列说法错误的是
| A.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒 |
| B.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| C.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 |
| D.对“地沟油’’蒸馏可以获得汽油 |
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)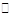 N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
| 温度 |
时间/min 物质的量 |
0 |
10 |
20 |
40 |
50 |
| T1 |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| T2 |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
x |
0.15 |
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),反应开始时,ν(正)>ν(逆)