氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。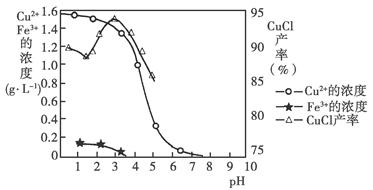
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为固体SiO2和H2O)
| 阳离子 |
K+ |
Ag+ |
Ca2+ |
Ba2+ |
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色胶状沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___________;
(2)实验Ⅰ中生成气体的离子方程式为____________________________ _____;
(3)通过实验Ⅰ、Ⅱ、Ⅲ,写出SiO32-物质的量浓度的计算过程:_____________________
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由: _____________________
Ⅰ.下列是用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 mL 0.5 mol·L-1的稀硫酸的实验操作,请按要求填空:
(1) 计算所需浓硫酸的体积为________mL(保留一位小数);
(2) 如果实验室有10 mL、20 mL、50 mL的量筒,应选________规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”)__________;
(3) 将量取的浓硫酸沿烧杯内壁慢慢注入盛有约少量水的烧杯里,并不断搅拌,搅拌的目的是______;
(4) 将冷却至室温的上述溶液沿玻璃棒注入________中,并用50 mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;在转移过程中有少量液体洒在桌子上,则最终所配浓度将(填“偏高”、“偏低”或“无影响”) 。
(5) 加水至距刻度线1~2 cm处,改用________加水至刻度线,使溶液的凹液面恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液。
II.)就有关物质的分离回答下面的问题,有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9[ |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是
(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话说明维生素C在这一反应中起的作用________。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,黑火药在发生爆炸时,发生如下的反应:S+2KNO3+3C= K2S + N2↑+3CO2↑;其中被还原的元素是 ,被氧化的元素是 ;氧化剂是 ,还原剂是 ;氧化产物是 ,还原产物是 (填元素符号或物质的化学式)。
下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题: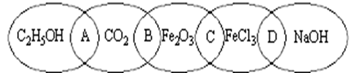
(1)两种物质都是电解质的是_______(填分类标准代号,下同),两种物质都是氧化物的是________。
(2)分类标准代号A表示______________(多项选择)
a.两物质都是非电解质 b.两物质都是有机物
C.两物质都是含碳化合物 d.两物质都是氧化物
(3)上述五种物质中的某相邻两种物质间能发生反应且有离子反应,写出该反应的离子方程式为: ____________________ _____________________。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为_____________。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的由线如图所示。请回答: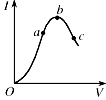
(1)“O”点导电能力为O的理由是 。
(2)a,b,c三点溶液中 c(H+)由小到大的顺序为 。
(3)a,b,c三点中电离程度最大的是 。
(4)使C点溶液中C(CH3COO-)增大,溶液c(H+)减小,可采取的
措施是:① ② ③ (至少填两个空)