(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=。
2NH3(g)的△H=。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3);
②达到平衡时NH3的体积分数为。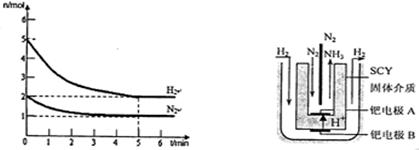
图1图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B 的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为。
②已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式。
下列各图中的纵坐标表示沉淀的物质的量,横坐标表示加入x的物质的量,请将各图一一对应的反应的代号填入每图下方的括号内。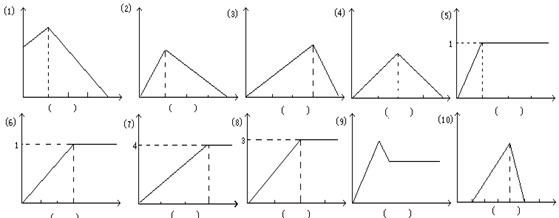
| A.Ca3(PO4)2悬浊液中滴入H3PO4 | B.NaAlO2溶液中通入HCl |
| C.Ba(OH)2溶液中通入SO2 | D.石灰水中通入CO2 |
E.AlCl3溶液中滴入氨水 F.AlCl3溶液中滴入NaAlO2溶液
G.SO2溶液中通入H2S气体 H.稀硫酸中滴入Ba(OH)2溶液
I.AlCl3、MgSO4的混合溶液中加入过量NaOH溶液
J.在盐酸酸化的AlCl3溶液中,滴入KOH溶
K.AlCl3溶液中滴入NaOH溶液
已知存在如下反应:(以下方程式均未配平)
其中A和C 为常见的金属单质;B和D为氧化物且B具有磁性;E为无色气体单质,据此回答:
(1)物质E是
(2)写出A与氢氧化钠溶液反应的离子方程式:
(3)若将B溶于盐酸中可形成溶液F,F中存在的两种金属阳离子是,
(填离子符号)
现有如下两种检验F中的低价金属阳离子的实验方案(包括实验步骤及预设实验 现象):
现象):
分别取少量F溶液于两支洁净的试管中
方案1:向第一支试管中滴加KSCN溶液,溶液不变色,再滴加氯水,溶液变红色
方案2:向第二支试管中滴加酸性KMnO4溶液振荡,KMnO4溶液的紫色退去
上述两种方案中合理的是(填方案1或方案2)
若有不合理 的请说明理由(若均合理此空可以不填)
的请说明理由(若均合理此空可以不填)
(4)若向溶液F中加入少量铜粉,振荡后,铜粉逐渐溶解,请写出此过程中发生的离子方程式
下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
(1 )请在上表中用实线补全元素周期表边界。
)请在上表中用实线补全元素周期表边界。
(2)写出①、③两种元素组成的正四面体化合物的电子式上述元素中,上述元素中能和⑤号元素形成正四面体空间网状结构的化合物的化学式是
(3)上述元素中的一种元素其气态氢化物和该元素的最高价氧化物的水化物能发生化合反应,该反应的化学反应方程式为____________________________________________________
该物质含有的化学键是。