某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质。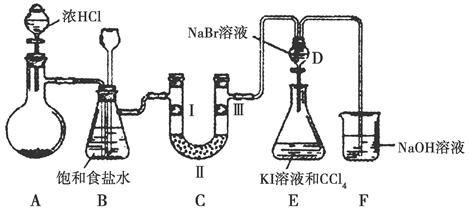
(1)若A装置中固体药品为KClO3,则反应中每生成1 mol Cl2时转移电子的物质的量为________mol。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是________。
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是____________________。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象:_______________。
(5)请用化学方程式说明装置F的作用:____________________。
(6)甲同学提出,装置F中的试剂可改用足量的Na2SO3溶液,乙同学认真思考后认为此法不可行。请用离子方程式解释乙认为不可行的原因:____________________________________。
碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3- I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
实验原理:
为了测定平衡时的c(I3-),可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。由于溶液中存在I3- I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1).用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2).将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3).分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4).带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入(填“酸式滴定管”或“碱式滴定管”),原因是。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是。
③滴定时向待测液中加入的指示剂是,到达滴定终点时的现象为。
④用c 、V1和V2表示c(I3-)为mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)
(17分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。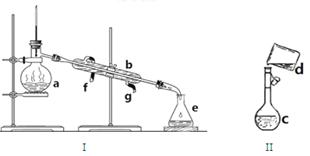
(1)写出下列仪器的名称:a.、b.、c.
(2)仪器a~e中,使用前必须检查是否漏水的有(填序号)
(3)若用装置I分离水和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由口通入,口流出(填f或g)
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是
②除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:
③根据计算得知,所需NaOH的质量为g
④配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称一定质量的NaOH固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.恢复到室温后将NaOH溶液沿玻璃棒注入500mL的容量瓶中(有少量溶液因操作不慎溅出瓶外) |
| D.将容量瓶盖紧,振荡、摇匀 |
E.改用胶头滴管加水,仰视使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
⑤按以上操作步骤配得的NaOH溶液的物质的量浓度(填“偏大”、“不变”或“偏小”)
(15分)
I2O5是白色固体,遇水生成碘酸(HIO3)。I2O5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应)。
实验一:制取I2O5
将碘酸加热至90~110 ºC使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I2O5的化学方程式: 。
(2)在制得的I2O5固体中含有少量I2杂质,提纯的方法是 (填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
该提纯方法用到的玻璃仪器为 (填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO利用下图装置检验空气中是否存在CO。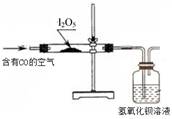
(3)能说明空气中含有CO的现象是 。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案: 。
实验三:测定空气中CO的含量
(5)将I2O5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L-1 Na2S2O3溶液。则该空气样品中CO的体积分数是 。
(6)该实验方案存在的一个明显缺陷是 。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。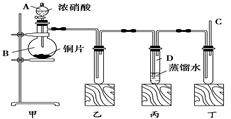
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式______________。
(2)实验过程中,装置乙、丙中出现的现象分别是_________________________、____________________;
装置丙中的试管内发生反应的离子方程式为:_____________________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______________________________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
实验室需要0.5 mol·L-1硫酸溶液480 ml。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是______(填序号),在使用如下B、C两种仪器前都应进行的操作。
(2)下列操作中,容量瓶所不具备的功能有______ __(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
(3)根据计算,用量筒量取18.4 mol·L-1的浓硫酸体积为___ ___ ml, 如果实验室有10 mL、15 mL、20 mL量筒,选用ml的量筒最好。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.5 mol·L-1(填“大于”、“等于”或“小于”,下同)。若浓硫酸在烧杯中溶解后,未冷却至室温就转移至容量瓶,则所得溶液浓度________0.5 mol·L-1。