甲同学欲配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制该溶液,需要浓硫酸的体积为________mL;所选用容量瓶的规格为________mL。
(2)甲同学的配制步骤:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是________。
②定容的正确操作是继续加蒸馏水至离刻度线下________时,改用________加水至液面与刻度线相切。
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号,下同)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(3)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出
B.定容时俯视读取刻度
C.容量瓶用蒸馏水洗净后未干燥
D.定容时液面超过了刻度线
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K= 。(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,此时v (正)_____________ v (逆)(填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2b.2CO2 + 6H2
C6H12O6+6O2b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2  CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应b中理论上原子利用率为 。
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂是 (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法是 ;
(3)将所得沉淀充分干燥,称量沉淀的质量为mg,由此可以计算ω(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得ω(Na2CO3) (填“偏大”、“偏小"或“无影响”)。
方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中ω(Na2CO3)。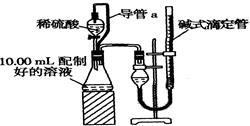
(1)装置中导管a的作用是 。
(2)若撤去导管a,使测得气体体积 (“偏大”,“偏小”或“无影响”)。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++CO32—=HCO3—恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择 仪器来完成。
(2)判断滴定终点的依据是 。
(3)此法测得ω(Na2CO3)= %。
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
已知:i.Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii.Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii.KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3
溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2②Ba(NO3)2③BaCO3④Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
分,除标注每空分外,其余每空掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
(1)写出下列仪器的名称:
a. b. c.
(2)仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 。将仪器补充完整后进行实验,温度计水银球的位置在____ __处.冷凝水由____________(填f或g)口通入,___ ___口流出。
(4)现需配制0.1mol·L-1NaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。(写一条)
除了图中给出的仪器和托盘天平外,为完成实验还需要的玻璃仪器有:_____ 、_
②根据计算得知,所需NaOH的质量为______________g。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作:
A.称量时用了生锈的砝码
B.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
C.往容量瓶转移时,有少量液体溅出
D.未洗涤溶解NaOH的烧杯
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
上述操作中所配溶液的物质的量浓度偏大的有(填写字母)_______________
通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、
碱、盐溶液均不反应。已知乙二酸晶体加热分解的方程式为:H2C2O4 H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
H2O + CO2↑+ CO↑,不考虑其他因素干扰,如何利用下列装置验证反应产物中含有CO2和CO(装置可以重复使用)。酒精喷灯可作高温热源。
请回答下列问题:
(1)检验装置A气密性良好的方法是
(2)从左到右连接装置的顺序是:A→ ;
(3)证明CO存在的实验现象是 ;
(4)本实验尾气处理的方法是 。