通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K= 。(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,此时v (正)_____________ v (逆)(填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。

(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2 b.2CO2 + 6H2
C6H12O6+6O2 b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2  CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应b中理论上原子利用率为 。
(11分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: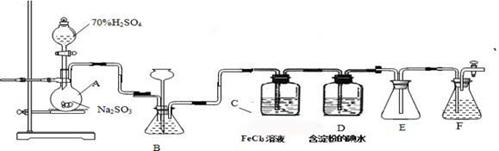
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若,则整个装置气密性良好。装置E的作用是。装置F中为溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,
写出有关离子方程式:
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行: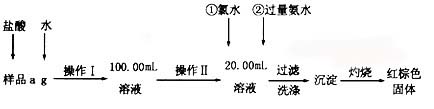
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、(填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为;
(3)若不用氯水,可用下列试剂中的代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为
(请把结果约到最简)。
(16分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。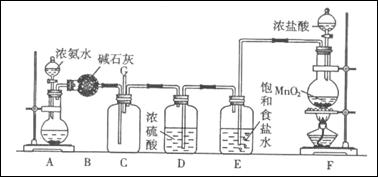
请回答下列问题:
(1)装置F中发生反应的离子方程式为。
(2)装置A的烧瓶中可装试剂为。
(3)B装置的名称是; E装置的作用是。
(4)通入C装置的两根导管左边较长、右边较短,目的是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(a、b的代数式表示)。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是。
A.200 mLB.300 mLC.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)=;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将(填“偏大”、“偏小”或“无影响”)。
科学探究
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究。请按要求填写。
(1)观察不同时间试管内的H2和O2体积的比值均约为。
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成H2、O2的质量,计算过程如下:
并填表如下:
| 质量g |
物质的量mol |
H2和O2物质的量的比 |
|
| H2 |
|||
| O2 |
根据该实验的观察与推算初步得到关于气体体积规律的一个结论是:在相同的温度和压强下,
(3)下表列出了一些物质的体积
| 条件 |
物质 |
1 mol物质的体积 |
| 0℃101kPa |
H2 |
22.3 L |
| O2 |
22.4 L |
|
| CO2 |
22.4 L |
|
| 25℃101kPa |
H2 |
24.4L |
| O2 |
24.5L |
|
| CO2 |
24.5L |
根据上表数据,得出的结论是(至少写出三点)
①在相同的温度压强下,
②
③
④
(4)请从微观的角度解释气体体积变化规律的原因: