随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g) ⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) △H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
1.00 |
0 |
0 |
||
| 10 |
0.58 |
0.21 |
0.21 |
||
| 20 |
0.40 |
0.30 |
0.30 |
||
| 30 |
0.40 |
0.30 |
0.30 |
||
| 40 |
0.32 |
0.34 |
0.17 |
||
| 50 |
0.32 |
0.34 |
0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在图中画出30min至40min的变化曲线。

“百度百科:乙醇,俗称酒精,在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有酒香的气味,并略带刺激性,微甘。易燃,能与水以任意比互溶。用途很广,可用制造饮料、染料、燃料等。在国防工业、医疗卫生、有机合成、食品工业、工农业生产中都有广泛的用途。”根据所学知识回答下列问题
(1)书写乙醇催化氧化的产物和新制银氨溶液反应的化学方程式:
(2)在120℃,101kpa条件下,取ag乙醇在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加了bg,则ab(填“=”“>”“<”)
(3)乙醇燃料电池,KOH作电解质,书写负极电极反应式:
(4)请用所学知识解释为什么乙醇能和水以任意比互溶
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。
(1)亚磷酸是_______元酸。
(2)PCl3水解可制取亚磷酸:PCl3+3H2O=_________
(3)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-
H++H2PO3-
①某温度下,0.10mol∙L-1的H3PO3溶液pH=1.6,即溶液中c(H+)=2.5×10-2mol∙L-1。求该温度下上述电离平衡的平衡常数K=_______。(只考虑H3PO3的第一步电离,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH_____7(填“>”“=”“<”)
(4)亚磷酸具有还原性,可使碘水褪色。该反应的化学方程式为_______________。
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下: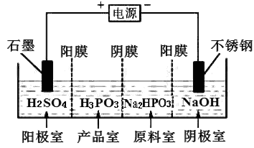
①阴极的电极反应式为__________。②产品室中反应的离子方程式为__________________。
肼(N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)写出肼的电子式,1mol N2H4 中有个极性共价键。
(2)NH3与NaClO反应可以得到肼,该反应的化学方程式为。
(3)发射火箭时,肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。
已知1.6g液态N2H4在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式:_________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时负极反应式为。
(5)肼性质与氨气相似,易溶于水,可发生如下电离过程:
I、N2H4+H2O N2H5++OH— II、N2H5++H2O
N2H5++OH— II、N2H5++H2O N2H62++OH—
N2H62++OH—
①常温下,某浓度N2H6C12溶液的pH为5,则该溶液中由水电离产生的c(OH—)=。
②已知在相同条件下过程I的进行程度大于N2H5+ 的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则溶液中N2H5+ 、N2H4·H2O、Cl—、OH—、H+粒子浓度由大到小的顺序为____________。
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下: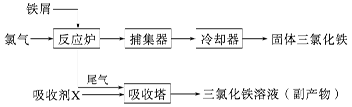
(1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为________________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度 (g/100 g H2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是__________________________。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+ 开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1 ( 已知:Ksp[Fe(OH)3]=1.1×10-36 ) 。
(4)吸收剂X是__________________;吸收塔中吸收剂X的作用是_______________________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容; 取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1 Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL。则样品中氯化铁的质量分数为____。
Ⅰ、在容积为2.0 L的密闭容器内,物质D在 T ℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题: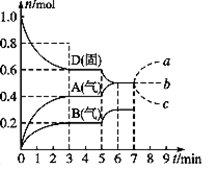
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据上图写出该反应的化学方程式______________,该反应的平衡常数K=____________。
(3)第5 min时,升高温度,A、B、D的物质的量变化如上图,则降温该反应的平衡常数______。(填“增大”“减小”或“不变”)。
(4)若在第7 min时增加D的物质的量,A的物质的量变化正确的是_______(用图中a、b、c的编号回答)。
Ⅱ、可逆反应①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示,则:
(5)达平衡(I)时体系的压强与反应开始时体系的压强之比为_____________
(6)达平衡(I)时,X的转化率为_______________
(7)X(g)+2Y(g) 2Z(g) 是_______热反应。
2Z(g) 是_______热反应。