氮元素的化合物种类繁多,性质也各不相同。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:
2NH3(g) N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| 总压强p 100 kPa |
5 |
5.6 |
6.4 |
6.8 |
7 |
7 |
则平衡时氨气的转化率为___________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。在空气中完全燃烧生成氮气,当反应转移0.2mol电子时,生成气体在标准状况下的体积为______________。联氨溶于水可以发生与氨水类似的电离,试写出联氨在水溶液中的电离方程式:
__________________(写一步即可)。
(4)NH4+在溶液中能发生水解反应。在25℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-5 mol/L,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3·H2O)=__________________。
“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1) 其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) ="=" C2H4(g)+3O2(g)ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) ="=" C2H5OH(1)+3O2(g)ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
| 500 |
600 |
700 |
800 |
|
| 1.5 |
45 |
33 |
20 |
12 |
| 2 |
60 |
43 |
28 |
15 |
| 3 |
83 |
62 |
37 |
22 |
根据上表中数据分析:
① 温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”“不变”)。
② 该反应的正反应为 (填“吸”或“放”)热反应。
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+ CO2(g) CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。
CH3OH(g)+ H2O(g)。2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L。下列判断不正确的是 。
a. 该条件下此反应的化学平衡常数表达式为
b. H2的平均反应速率为0.3mol/(L·s)
c. CO2的转化率为60%
d. 若混合气体的密度不再改变时,该反应一定达到平衡状态
|

已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁, D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18。下列框图中部分反应条件已略去。
试回答下列问题: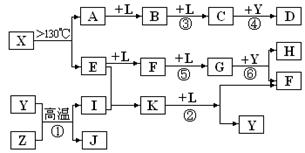
(1)下列有关X的说法正确的是.
A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为,D的分子式,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是。(填序号)
(3)写出反应②的化学方程式:。
(4)J与过量H的稀溶液反应的离子方程式为。
Ⅰ.玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是
(填写编号)
①用pH试纸测定Na2CO3溶液的pH; ②配制一定物质的量浓度的氯化钠溶液; ③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体; ④探究Ba(OH)2 8H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
8H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案。
【方案一】准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量。
(1)此方案中,酸碱中和滴定时应选用指示剂是。
【方案二】准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
(2)该方案的实验过程中,仪器的连接顺序是(填仪器下方序号),①中的进气口为(填“A”或“B”)
(3)装置⑤的作用是。
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案。
A~J均为有机化合物,它们之间的转化如下图所示: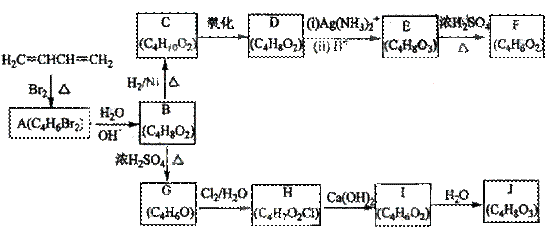
实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;
④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为____________(不考虑立体结构),由A生成B的反应类型是____________反应;D的结构简式为_____________;
(2)由E生成F的化学方程式为_______________,E中官能团有_________(填名称),与E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(3)G的结构简式为_____________________;
(4)由I生成J的化学方程式______________。
已知:

(式中X代表卤素原子)有以下反应,最终产物是乙二酸。
试 回答下列问题:
回答下列问题:
(1)C的结构简式是;
(2)B→C的反应类型是;
(3)E→F的化学方程式是;
(4)写出E与乙二酸发生酯化反应生成环状化合物的化学方程式 ;
;
(5)写出E与乙二酸反应生成高分子化合物的化学方程式
;
(6)由B发生水解反应或C发生水化反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是 。
。