氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。
(6)已知
计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
在100℃和200kPa的条件下,反应aA(g) bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
| 压强(kPa) |
200 |
500 |
1000 |
| B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡移动(填“正向”或“逆向”或“不”),理由是。
(2)压强从500kPa增加到1000kPa时,平衡移动(填“正向”或“逆向”或“不”),其原因可能为。
把氯气通入稀氨水中,NH3分子上的一个H被Cl取代生成氯氨,然后加入过量的氨和氯氨作用,得到 联氨(N2H4)。
联氨(N2H4)。
(1)写出上述反应的化学方程式:________ __________
(2)联氨是一种可燃性液体,可用作火箭燃料。已知32.0g N2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是:
____________________________________________
(3)联氨的水溶液显弱碱性,用离子方程式表示其显弱碱性的原因:
_______________________________________________
(4)联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。联氨—空气燃料电池放电生成N2和H2O,其电极反应式是:正极________________________;负极_____________________。
下表是A、B、C、D、E五种有机物的有关信息;
 根据表中信息回答下列问题:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做;写出在一定条件下,A生成高分子化合物的化学反应方程式_______。
(2) A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3) B具有的性质是(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:。
(4) E反应能生成(C3H4O2)n的物质,该反应类型为 ;工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10
;工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10
 %,其目的是。
%,其目的是。
(5) 写出由C氧化生成D的化学反应方程式:。
(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化: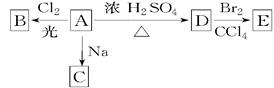
①A分子中的官能团名称是____________;
②A只有一种一氯取代物B,写出由A转化为B的化学方程式:________________________________________________________________________;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种,F的结构简式是
______________________________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)____________________。
①加成反应 ②氧化 反应 ③加聚反应 ④水解反应
反应 ③加聚反应 ④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是______________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到分子式为C10H12O2Na2的化合物。
“TBHQ”的结构简式是____________________。
(12分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________________________;
(3)写出0.1  的
的 溶液中离子浓度大小排序________________;
溶液中离子浓度大小排序________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为