某课题组拟采用苯酚和化合物B为主要物质合成有机中同体M(C16H14O4)。
已知:I.R—COOH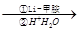 R—CHO;
R—CHO;
Ⅱ.经红外光谱检测研究确认,有机物M含有2个“C-O-C”结构。且lmolM与足量的银氨溶液反应能生成4molAg。
(1)利用乙醇制备乙烯的过程中,浓H2SO4的作用是___________。
(2)①有机物B中含有的官能团名称是________________。
②有机物B在X溶液作用下可生成乙二醇,则X为___________(填化学式)。
(3)有机物C分子苯环上有两个对位的取代基,写出有机物C的结构简式_____。
(4)①有机物D中不能发生的反应类型是___________。(选填序号,下同)
a.取代反应 b.消去反应 c加成反应 d氧化反应
②有机物Y与D互为同分异构体,写出符合下列条件的Y的结构简式________。
i.含有苯环,苯环上的一卤代物有3种同分异构体
ⅱ.能与新制的氢氧化铜悬浊液反应产生砖红色沉淀
ⅲ.1molY最多能与2moINaOH溶液反应
(5)下列关于有机物M的说法正确的是__________。
a.能发生还原反应
b.M是高分子化合物
c.能使酸性KMnO4溶液褪色
d.可与FeCl3溶液发生显色反应
e.能与浓溴水发生化学反应,生成白色沉淀
(6)写出由有机物B与有机物D合成M的化学方程式_________________________________。
A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
(1)B和C均为有支链的有机化合物,B的结构简式为__________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为__________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为________。
(3)写出⑤的化学反应方程式____________________________________________。⑧的化学反应方程式____________________________________________。
(4)①的反应类型________,④的反应类型________,⑦的反应类型________。
(5)与H具有相同官能团的H的所有同分异构体的结构简式为___________________。
金刚烷是一种重要的化工原料,工业上可通过下列途径制备: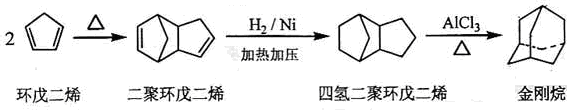
请回答下列问题:
(1)金刚烷的分子式为,其分子中的CH2基团有个;
(2)下面是以环戊烷为原料制备环戊二烯的合成路线: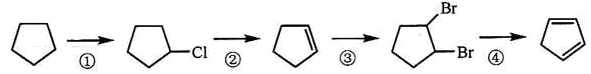
其中,反应①的反应试剂是,反应③的方程式,反应④的反应类型是;
(3)已知烯烃能发生如下的反应: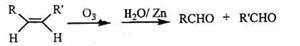
请写出下列反应产物的结构简式: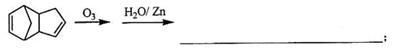
下列3种有机化合物A: CH2=CH-CH3 B: C:CH3CH2OH
C:CH3CH2OH
(1)写出化合物A、C中的官能团的名称、。
(2)A在催化剂加热条件下聚合生成聚合物的反应方程式为,反应类型为。
(3)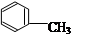 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:。
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:。
(4)B可以被酸性高锰酸钾氧化成苯甲酸,写出苯甲酸与C物质与浓硫酸共热发生酯化反应的化学方程式:。
除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
| 混合物 (括号内为少量杂质) |
试剂 (足量) |
分离方法 |
|
| A |
苯(苯酚) |
||
| B |
乙烯(SO2) |
||
| C |
乙酸乙酯(乙酸) |
||
| D |
乙醇(水) |
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气。
(1)请标出电子的转移方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为________,被氧化的还原剂
的物质的量为___________。
(3)需消耗36.5%的浓盐酸多少质量?