制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ•mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ•mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ•mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
甲、乙、丙、丁是四种短周期元素,乙原子有三个电子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是元素(填元素符号),甲的单质与水反应的化学方程式为
;
(2)乙是元素(填元素符号),原子结构示意图为;
(3)丙是元素(填元素名称),最高价氧化物对应水化物的化学式是;
(4)丁是元素(填元素名称),甲与丁两种元素可组成的物质有、。(填化学式)
根据所学知识填空
(1)第二周期第VIA族的元素是第几号元素?
(2)核电荷数为13的元素在周期表中的位置第周期第族
(3)原子核内有10个质子的原子
(4)核外有10个电子的+2价阳离子
(5)核外有18个电子的一1价阴离子
(6)L层为最外层,L层的电子数是K层的3倍的原子。
下面几题用“>”或“<”回答下列问题:
(7)酸性:H2CO3 H2SiO3 , H2SiO3H3PO4
(8)碱性:Ca(OH)2 Mg(OH)2,Mg(OH)2 Al(OH)3.
(9)气态氢化物稳定性:H2O H2S, H2S HCl 。
已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应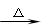
① A + H2O → B + C ② C + F → D ③ D + NaOH F + E + H2O
(1)写出它们的化学式:A、B、 D、
E、F;
(2)写出各步反应的离子方程式,并指反应①的氧化剂和还原剂物质的量比。
① 、氧化剂与还原剂物质的量比为:。
② 。
③ 。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式。
(9分)(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如下表所示:
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 。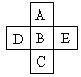
(Ⅱ)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A ,D ,E 。
(2)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 。
(共10分)下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最强的单质是,还原性最强的单质是;
(2)最高价氧化物的水化物中碱性最强的是,酸性最强的是,呈两性的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.最小的是。