(8分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
(1)写出下列物质的化学式:F中的溶质 _________; 丙____________。
反应③的离子方程式
H受热分解后的固体产物与金属B高温下的化学方程式:_______________________
A与水反应的离子方程式
已知W、X、Y、Z为四种短周期元素,原子序数逐渐增大。其中W形成 的单质是自然界中最轻的气体;X原子的最外层电子数是次外层电子数
的单质是自然界中最轻的气体;X原子的最外层电子数是次外层电子数 的2倍;元素是地壳中含量最多的元素;Z元素是短周期中原子半径
的2倍;元素是地壳中含量最多的元素;Z元素是短周期中原子半径 最大的元素。回答下列问题:
最大的元素。回答下列问题: (1)X6W6的结构简式为,分子空间构型为。
(1)X6W6的结构简式为,分子空间构型为。 (2)Y与Z形成的两种常见化合物的电子式分别为和
(2)Y与Z形成的两种常见化合物的电子式分别为和 (3)由W、X、Y三种元素形成的最简式为XW2Y的化合物有A和B两种,
(3)由W、X、Y三种元素形成的最简式为XW2Y的化合物有A和B两种, 其中A的相对分子质量是60,是日常生活中的一种调味品的主要
其中A的相对分子质量是60,是日常生活中的一种调味品的主要 成分,则A的结构简式为;B的相对分子质量是A的
成分,则A的结构简式为;B的相对分子质量是A的 3倍,在正常人的血液里含有0.1%的B,则B的分子式。
3倍,在正常人的血液里含有0.1%的B,则B的分子式。 将B物质的溶液与新制的Cu(OH)2悬浊液共热,观察到得现象
将B物质的溶液与新制的Cu(OH)2悬浊液共热,观察到得现象 是。
是。 (4)将B在酒化酶的作用下可制得另外一种具有特殊香味的液态有机
(4)将B在酒化酶的作用下可制得另外一种具有特殊香味的液态有机 物C,同时得到一种能导致温室效应的气体。写出该反应的化学
物C,同时得到一种能导致温室效应的气体。写出该反应的化学 方程式
方程式 (5)C是一种可以再生的清洁燃料,写出其燃烧的化学方程式
(5)C是一种可以再生的清洁燃料,写出其燃烧的化学方程式 。
。
C还可以在Cu或Ag的催化作用下 被氧气氧化成具有刺激性气味的液体,该反应的化学方程式为
被氧气氧化成具有刺激性气味的液体,该反应的化学方程式为 。
。









在烷烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子,试回答下列问题 (1)分子式为CnH2n+2的烃分子中碳碳间共用电子对数为_______________。
(1)分子式为CnH2n+2的烃分子中碳碳间共用电子对数为_______________。 (2)分子式为CnH2n-6的烃分子中碳碳间共用电子对数为_______________。
(2)分子式为CnH2n-6的烃分子中碳碳间共用电子对数为_______________。 (3)Cx可看作是烃减氢后的产物,若某物质分子中碳碳间的共用电子对数为160,则符合该条件通式为CnH2n的烃的分子式为________________________。
(3)Cx可看作是烃减氢后的产物,若某物质分子中碳碳间的共用电子对数为160,则符合该条件通式为CnH2n的烃的分子式为________________________。
立方烷是新合成的一种烃,其分子呈如图所示的立方体结构,立方体的每个顶点上都有一个碳原子和一个氢原子。

 (1)立方烷的分子式是。
(1)立方烷的分子式是。 (2)其一氯代物共有种。
(2)其一氯代物共有种。 (3)其二氯代物共有种。
(3)其二氯代物共有种。 (4)其三氯代物共有种。
(4)其三氯代物共有种。
有下列各组物质:
| A.O2和O3; | B.126C和136C; | C.冰醋酸和乙酸; | D.甲烷和庚烷;E.CH3-CH2-CH2-CH3和CH3CH(CH3)CH3; F.淀粉和纤维素。 |

 (1)互为同位素的是(2)互为同素异形体的是
(1)互为同位素的是(2)互为同素异形体的是 (3)互为同分异构体的是(4)同一物质是
(3)互为同分异构体的是(4)同一物质是 (5)互为同系物的是
(5)互为同系物的是
咖啡酸苯乙酯(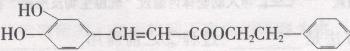 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化: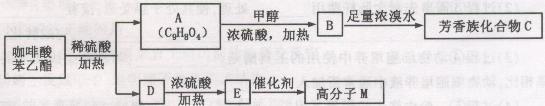
请填写下列空白:
(1)D分子中的官能团是;
(2)高子M的结构简式是;
(3)写出A→B反应的化学方程式;
(4)B→C发生的反应类型有;
(5)A的同分异构体有很多种,其中,同时符合下列条件的同分异构体有种。
①苯环上只有两个取代基②能发生银镜反应
③能与碳酸氢钠溶液反应④能与氯化铁溶液发生显色反应