下表为元素周期表的一部分,请回答有关问题:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号分别是__________和__________。
(2)表中最活泼的金属是__________,非金属性最强的元素是__________。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__________,分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:______________________________, ________________________________。
(4)请设计一个实验,比较⑦⑩单质氧化性的强弱:
_________________________________________________________________。
有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂。请将相应的序号填入空格内。
(1)能用于制备肥皂的是____________;(2)能用于制备聚乙烯塑料的是____________;
(3)能用于制备顺丁橡胶的是____________;(4)能用于制备酚醛树脂的是____________。
乙炔与乙烯类似,在催化剂(10%硫酸和5%硫酸汞的水溶液)的作用下,也可以与等物质的量的水发生加成反应。
(1)已知当羟基和双键碳原子直接相连,呈烯醇结构不稳定,会转化为羰基化合物: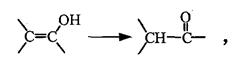
则乙炔和水加成的化学方程式是。
用如下装置完成乙炔和水的加成反应,加成产物收集在D装置中。(省略部分加热和夹持仪器)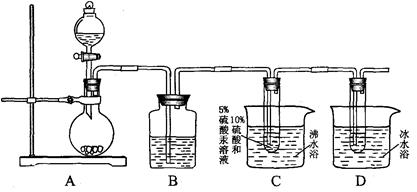
①实验室制备乙炔的化学方程式是。
②A装置制出的乙炔有难闻的气味,为除去这些杂质,装置B中盛放的试剂是。
③C装置采用沸水浴的作用是(填字母)。
a.便于控温,使受热均匀 b.加热反应物,提高化学反应速率 c.蒸出生成物
(3)为检验加成产物中的官能团,选择的药品是(填字母)。
a.金属钠 b.10%氢氧化钠溶液 c.2%硫酸铜溶液
d.2%硝酸银溶液 e.饱和碳酸钠溶液
检验官能团的实验中,发生反应的化学方程式是 。
有机物 与Br2发生1∶1加成反应,其可能的加成产物的结构简式有:
与Br2发生1∶1加成反应,其可能的加成产物的结构简式有:
。
某有机物的结构简式如右图所示,写出该有机物的分子式:。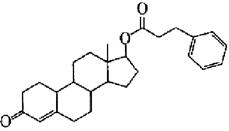
(12分)已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,他们之间有如下关系。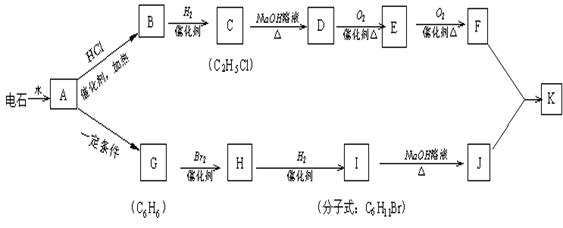
试回答下列:
(1)写出由G制取H的化学方程式:;
(2)写出C发生消去反应的化学方程式:;
(3)写出D→E的化学方程式:;
(4)B在一定条件下可合成一种重要的塑料,写出该合成反应的方程式:_________________;
(5)写出酯K的结构简式:;
(6)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛,
如: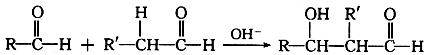
则乙醛在NaOH溶液作用下反应的化学方程式是: