如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。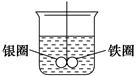
(1)片刻后可观察到的现象是(指悬吊的金属圈)________。
| A.铁圈和银圈左右摇摆不定 |
| B.保持平衡状态不变 |
| C.铁圈向下倾斜 |
| D.银圈向下倾斜 |
(2)产生上述现象的原因是________________________________________。
(3)写出反应的化学方程式:______________________________________。
有下列各组物质:
| A.O2和O3(臭氧) | B. |
C.CH3CH2CH2CH3和 |
D. |
E.葡萄糖和果糖 F.(CH3)2CH2与C(CH3)4
G.淀粉和纤维素 H.液氯与氯气
(1)组两物质互为同位素(2)组两物质互为同素异形体
(3)组两物质属于同系物(4)组两组物质互为同分异构体
(5)组中的物质是同一物质
(3分)下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号)属于烯烃的是,(填编号)
(2)上图中与B互为同分异构体但不属于同种类的物质的是:。(填编号)
(6分)已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
请回答下列问题:(1)写出A的结构简式。
(2)物质B可以被直接氧化为D,需要加入的试剂是。
(3)写出下列反应的化学方程式:
①;反应类型:。
④。反应类型:。
如图所示装置:
①若烧杯中溶液为稀硫酸,
电极反应式为:正极;
负极。
②若烧杯中溶液为氢氧化钠溶液,则负极为,
总反应方程为。
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
①由图中所给数据进行分析,该反应的化学方程式为;
②反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=,
③当反应进行了3 min,该反应是否达到平衡(填“是”或“否”)。
(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中
T1~T2速率变化的主要原因是____,
T2~T3速率变化的主要原因是___ ___