化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下列相关说法正确的是________(填序号)。
A.通过某种电池单位质量或单位体积所能输出能量的多少,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提上日程,其首要原因是电池外壳的金属材料需要回收
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应式可表示为2Ni(OH)2+Cd(OH)2 Cd+2NiO(OH)+2H2O
Cd+2NiO(OH)+2H2O
已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
A.以上反应是可逆反应
B.反应环境为碱性
C.电池放电时Cd作负极
D.该电池是一种二次电池
(3)在宇宙飞船和其他航天器上经常使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。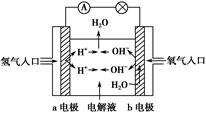
①a电极是电源的________极;
②若该电池为飞行员提供了360 kg的水,则电路中通过了________mol电子。
电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是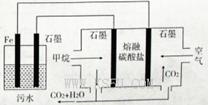
A.铁电极的电极反应式为: |
B.通人空气的石墨电极的电极反应式为 |
| C.若左池石墨电极产生44. 8L(标准状况)气体,则消耗氧气0. 5mol |
| D.为增强污水的导电能力,可向污水中加入适量工业用食盐 |
某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________(用含X、y、m、n的式子表示)。
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。
近几年,大气污染越来越严重,雾霾天气对人们的生活、出行、身体健康产生许多不利的影响。汽车尾气是主要的大气污染源。降低汽车尾气危害的方法之一是在排气管上安装催化转化器,发生的反应为:
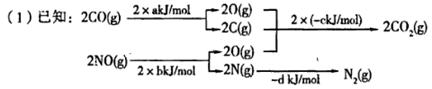
则 ,△H=__________kJ
,△H=__________kJ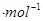 (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
(2)某温度下,向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示。
回答下列问题:
①该温度下,化学平衡常数K=___________,平衡时CO的转化率为__________。
②A点的逆反应速率逆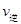 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率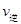 (NO)(填“>”、“<”或“=”)。
(NO)(填“>”、“<”或“=”)。
③下列图像正确且能表明在时间T1时刻反应一定处于平衡状态的是__________。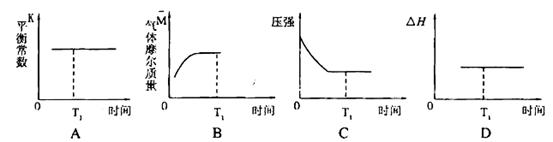
如果该反应达平衡后,降低温度,平衡常数增大,则△H___________0(填“>”、“< ”或“=”)
④达平衡后,将容器的容积扩大一倍,下列说法正确的是
| A.平衡向正反应方向移动 | B.CO的体积分数增大 |
| C.平衡常数减小 | D.一氧化碳的浓度增大 |
铝灰的回收利用方法很多,现用含有Al2O3,SiO2和少量FeO xFe2O3的铝灰制备Al2(S04)3
xFe2O3的铝灰制备Al2(S04)3 18H2O,工艺流程如下:
18H2O,工艺流程如下: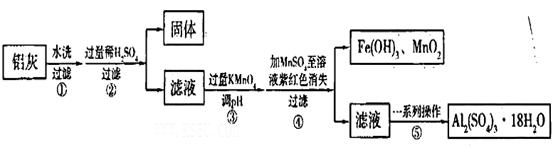
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是______________。
(2)流程中加人的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为_______________。
(3)已知:浓度均为O.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如下表: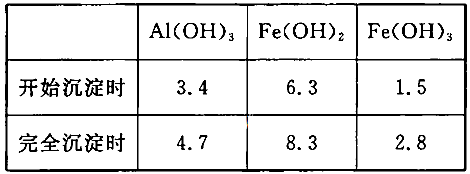
步骤③的目的是__________________________________________________________;若在该浓度下除去铁的化合物,调节pH的最大范围是___________。
(4)已知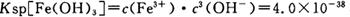 当pH=2时,Fe3+开始沉淀的浓度为_______________。
当pH=2时,Fe3+开始沉淀的浓度为_______________。
(5)操作④发生反应的离子方程式为__________________________________________;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是_________或_________。
(6)操作⑤“一系列操作",下列仪器中不需用的是___________(填序号)。
| A.蒸发皿 | B.坩埚 | C.玻璃棒 | D.酒精灯E.漏斗 |
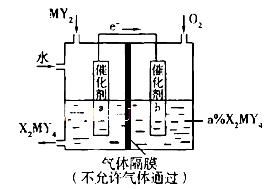
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大。 X、Y可形成最常用溶剂;X、Y、Z最夕层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g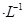 。请回答下列问题:
。请回答下列问题:
(1)Y、Z、M三种元素原子半径由小到大的顺序为(写元素符号)________________。
(2)Q在周期表中的位置是____________。
(3)X、Y、Q三种元素’形成的三原子分子结构式为______________;M、Q元素形成的最高价氧化物对应的水化物中较强的酸是(写化学式)_____________。
(4)Y与Z形成的化合物A既含离子键又含共价键,A的电子式为______________________;
将A加入盛有酚酞试液的试管中观察到的现象为_________________________________,发生反应的化学方程式为_________________。
(5)利用下列装置可将化合物MY2转化为重要化工原料H2MY4。电极a的催化剂表面发生的电极反应方程式为__________________________________;理论上通人MY2与O2的物质的量最佳比值为________________。