关于平衡常数表达及影响因素的易混易错题组
运用化学反应原理研究碳、氮等单质及其化合物的反应有重要意义。
(1)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
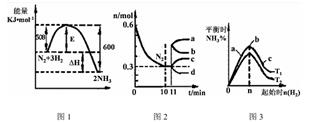
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2分析,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
②为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(3)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

将Na2O2和NaHCO3固体混合物置于密闭容器中加热充分反应,放出气体后冷却。加热时可能发生的反应如下:
2Na2O2+2NaHCO3 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑
2Na2O2+4NaHCO3 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)若固体混合物的质量为m,反应后冷却再称其质量减少了Δm。设NaHCO3、Na2O2的物质的量分别为a、b,试确定下列条件下Δm的取值范围(用含m的代数式表示)。
①当a/b≤1时,Δm取值范围是_____________________。
②当1<a/b≤2时,Δm取值范围是___________________。
③当a/b>2时,Δm取值范围是______________________。
(2)若m="14.52" g,Δm=" 1.28" g时,向反应后的残留固体内滴加2.00 mol·L-1盐酸140.0 mL,可产生标准状况下的气体____________ L。
在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①_________________________;②_________________________;将处理后的气体充入座舱时,应注意采取的一项措施是___________________________。有人提出用超氧化钾(KO2)代替过氧化钠供氧,预计其优点是_________________________________。
用A、B两种常见化合物组成混合物,A、B的焰色反应均为黄色,其相互转化关系如下图(其他物质略去)。
根据以上关系,完成下列问题:
(1)写出A、B、C、D的化学式:
A_____________________________________,
B_____________________________________,
C_____________________________________,
D_____________________________________。
(2)写出混合物与水反应的化学方程式:___________________________________________。
(3)加热后,若只得到一种固体化合物,则A与B的质量之比的最大值为___________。
有A、B、C、D、E、F、G、H、I九种常见物质。已知:①其中只有B、C、F为单质,且常温常压下,B为固态,C、F为气态;②化合物中仅A、E为气态;③在常温下,D为淡黄色粉末;④H的焰色反应呈黄色。它们的转化关系(反应条件未注明)如图所示:
试完成下列问题:
(1)写出A与D反应的化学方程式:______________________________________________。
(2)写出B与G反应的化学方程式:______________________________________________。
(3)写出D的电子式和A的结构式:______________________________________________。
(4)用电子式表示G的形成过程。________________________________________________。
A、B、C、D、E、F六种物质都易溶于水,水溶液除F外都能使石蕊试液变蓝色,六种物质火焰都呈黄色。A、B与水反应时,都有气体产生,A放出的气体具有还原性,B放出的气体具有氧化性,A、B溶于水时都产生C。C与适量的二氧化碳反应生成D,C与过量二氧化碳反应生成E,而固体E加热时产生D。F的水溶液能使石蕊试液变红色,在F的溶液中加入氯化钡溶液产生白色沉淀,F与D反应产生二氧化碳。试推断六种物质分别是:A____________,B_____________,C____________,D____________,E____________,F____________。(填化学名称)