N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
100 0 |
150 0 |
| c(N2O5)/ mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
B.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
C.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
大量汽车尾气也会引起酸雨。下列汽车尾气中能引起酸雨的是
| A.N2 | B.CO | C.NO2 | D.CO2 |
根据 C含量,能测出古代物品所处的年代。
C含量,能测出古代物品所处的年代。 C中的“14”是指碳原子中的
C中的“14”是指碳原子中的
| A.质子数 | B.中子数 | C.电子数 | D.质量数 |
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
| A.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ |
| B.c(Fe2+)︰c(Cu2+) = 2︰1 |
| C.c(Fe2+)︰c(Fe 3+) = 3︰1 |
| D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L |
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
| C.上图中a极为镁条、b极为锌片时,导线中会产生电流 |
| D.上图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
下图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是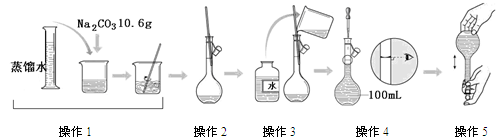
| A.所配制的Na2CO3溶液的物质的量浓度为1.0 mol/L |
| B.操作2是将溶解的Na2CO3溶液转移到容量瓶中 |
| C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐 |