下表为长式周期表的一部分,其中的编号代表对应的元素。
(1)元素③基态原子的电子排布式为 。
(2)②与⑦形成的化合物的空间构型为 。
(3)元素②④⑤⑥的第一电离能由大到小的顺序是 (填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因 。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是 
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.在上述结构示意图中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
合成氨反应,在其他条件不变,增大体系压强10倍,化学反应速率可增大___________倍。
在2L密闭容器中发生下列反应:

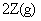 ,若最初加入的X、Y、Z都是2mol,反应中X的平均反应速率为0.12 mol/L·s,若要产物Z为2.6mol,反应需要的时间为___________。
,若最初加入的X、Y、Z都是2mol,反应中X的平均反应速率为0.12 mol/L·s,若要产物Z为2.6mol,反应需要的时间为___________。
(12分)有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定质量的这些烃完全燃烧后生成mmol CO2和nmol H2O。
(1)当m=n时,该烃是__________________。
(2)当m=2n时,该烃是__________________。
(3)当2m=n时,该烃是__________________。
(4)当4m=7n时,该烃是__________________。
(10分)(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C==CHCH3 |
10.4 |
| CH3CH==CH2 |
2.03 |
| CH2="=" CH2 |
10.0 |
| CH2==CHBr |
0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C==C上取代基的种类、个数间的关系:____________________________________。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是_________。
| A.(CH3)2C==C(CH3)2 |
| B.CH3CH==CHCH3 |
| C.CH2="=" CH2 |
| D.CH2==CHCI |
随着科学技术的发展,人们对物质微观结构的认识不断深入。下图是NaCl晶体
的结构示意图,该晶体中阴离子的堆积方式为_______________。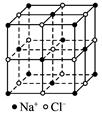
(1)已知阿伏加德罗常数的值(Na),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,则NaCl晶体的密度为_______________g·cm-3。
(2)某化学课外小组尝试在实验室中测定NaCl晶体的密度,其实验方案如下:先将固体NaC
l研细,准确称量mgNaCl粉末并转移到容积为100 mL的定容仪器A中。然后,向A仪器中
滴加苯,并不断振荡,至恰好达到刻度线时,测得加入苯的体积为V mL。
①定容仪器A最好选用______________________________ (填仪器名称)。
②能否用水代替苯_______________ (填“能”或“不能”);其理由是____________________。
③向仪器A中滴加苯时要不断振荡的目的是_______________________________________。
④使用该方法测得NaCl晶体的密度为_______________g·cm-3。