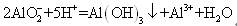在三种不同条件下,分别向容积为2L的恒容容器中加入2molA和1molB,发生反应如下:2A(g)+B(g) 2D(g) △H=Q kJ·mol-1,相关条件和数据见下表。
2D(g) △H=Q kJ·mol-1,相关条件和数据见下表。
| |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
| 反应温度/℃ |
800 |
800 |
850 |
| 达到平衡所需时间/min |
40 |
a |
30 |
| D物质平衡浓度/mol·L-1 |
0.5 |
b |
0.6 |
| 反应的能量变化/ kJ |
Q1 |
Q2 |
Q3 |
下列说法正确的是
A.当容器中气体的相对分子质量不再发生变化时,说明该反应达到平衡状态
B.如果实验Ⅱ相比实验Ⅰ使用了催化剂,则a>40, b=0.5
C.实验Ⅲ达到平衡时,向其中通入少量惰性气体,容器压强增大,平衡向右移动
D.由表中信息可知Q<0,并且有Q1 =Q2<Q3
F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。
下列判断中正确的是
| A.F一般无正价,但在HFO中的F价态为+1 |
| B.XeF2分子中各原子均达到8电子结构 |
| C.XeF4按已知方式水解,反应中氧化剂为XeF4、还原剂为H2O |
| D.XeF4按已知方式水解,每生成4molXe,转移16mol电子 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g AlX溶液Al(OH)3沉淀
方案②:2.7 g AlY溶液Al(OH)3沉淀
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和 Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )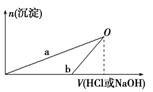
| A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.在O点时两方案中所得溶液浓度相等 |
| D.a、b曲线表示的反应都是氧化还原反应 |
合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此 反应平衡的影响。
反应平衡的影响。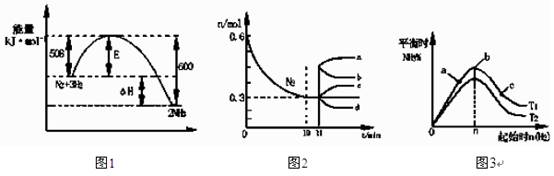
下列说法正确的是:
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其 它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
Cu2O呈红色,在酸性条件下会发生自身氧化还原反应。用H2还原CuO所得产物呈红色,若要检验其中是否含有Cu2O,以下试剂选择和判断方法均正确的是:
| 选项 |
试剂 |
判断方法 |
| A |
稀硝酸 |
是否生成蓝色溶液 |
| B |
稀硫酸 |
固体物质是否完全溶解 |
| C |
浓硫酸 |
是否有无色气体生成 |
| D |
稀盐酸 |
是否生成蓝色溶液 |
下列离子方程式书写不正确的是
| A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时, 4OH- + 3SO2 = SO32-+ 2HSO3-+ H2O |
| B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2--= CuS↓ |
| C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时, 2Fe2+ + 4Br- +3Cl2 =" 2" Fe3+ + 2Br2 + 6Cl- |
| D.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合: |