生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________________________ ________________________________________________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是____________;1 mol甲醛分子中σ键的数目为________。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为________。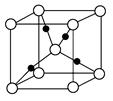
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X |
动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y |
地壳中含量居第一位 |
| Z |
短周期中其原子半径最大 |
| Q |
生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M |
海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式。
根据Mg与CO2的反应推测,Na也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。某兴趣小组用如下装置开展两个阶段的实验探究。
【实验I】引发CO2与Na反应。操作步骤为:
①按图连接装置,检验装置气密性,并往各装置中加入试剂;
②打开装置a上活塞一段时间;
③点燃d处酒精灯,使CO2与Na充分反应。停止加热,继续通气体使双通管冷却。
回答下列问题:
(1)装置a中用到的玻璃仪器有试管和 ;(2)装置b中装入的试剂是 ;
(3)装置c的作用是 ;(4)步骤②中,当观察到 时,才能进入步骤③。
【实验Ⅱ】探究反应产物及反应机理。取反应后双通管中固体物质29.2 g进行如下实验:
①仔细观察固体,发现有黑色颗粒;
②将固体溶于足量的水并过滤、洗涤,得到1.8 g滤渣(干燥);
③将滤液加水稀释配成250 mL的溶液;
④取少量③的溶液,先加足量BaCl2溶液,观察到白色沉淀;将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为3.94g。向滤液中再加几滴酚酞试液,溶液变红;
⑤取25.00 mL③的溶液,滴加甲基橙作为指示剂,用3.0 mol·L-1盐酸滴定,消耗盐酸体积为20.00 mL。
回答下列问题:
(5)如何判断⑤中的滴定终点
(6)反应后装置d中的固体物质为 ;通过计算分析:29.2 g残留固体中,各组分的质量各是多少?
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)焙烧硫铁矿的主要方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式) 。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:
(5) 如果将氯化铁晶体(FeCl3·6H2O)放在坩埚中加热灼烧,最后得到的固体为 。
(6)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
2SO3(g),该反应的平衡常数表达式为K= ; 工业在接触法制硫酸的生产中,采取下列哪些措施有利于提高SO2转化率 。
①V2O5作催化剂②通入过量O2③SO2、O2进行二次氧化④通入过量SO2
(I)下图是工业生产硝酸铵的流程。
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:①4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g)△H =-1266.8kJ/mol
②N2(g) + O2(g) = 2NO(g)△H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
35 |
50 |
60 |
70 |
80 |
| 温度/℃ |
25 |
26 |
26 |
26 |
26 |
26 |
26.5 |
27 |
27 |
27 |
27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(6)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 |
铜片 质量/g |
0.1mol·L-1的 硝酸体积/mL |
硝酸铜 晶体/g |
亚硝酸钠 晶体/g |
实验目的 |
| ① |
5 |
20 |
_______ |
_______ |
实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② |
5 |
20 |
0.5 |
0 |
|
| ③ |
5 |
20 |
0 |
0.5 |
液晶高分子材料应用广泛。新型液晶基元------化合物Ⅳ的合成线路如下:
(1)化合物Ⅰ的分子式为__________ ,1mol化合物Ⅰ完全燃烧消耗_____molO2。
(2)CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为_____(注明条件)。
(3)写出符合下列条件的化合物Ⅰ的同分异构体的结构简式。
I. 苯环上有3个取代基 II.苯环上一溴代物只有2种III.能发生银镜反应
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
| A.属于烯烃 | B.能与FeCl3溶液反应呈紫色 |
| C.一定条件下能发生加聚反应 | D.最多能与4molH2发生加成反应 |
(5)反应③的反应类型是____________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是______________。