铝是地壳中含量最多的金属元素,1854年法国化学家德维尔用金属钠还原氯化钠和氯化铝的复盐,获得了铝单质。1886年,美国人豪尔和法国人海郎特,分别独立地电解熔融的氧化铝和冰晶石的混合物,制得了金属铝,奠定了今天大规模生产铝的基础。
工业生产金属铝的原料是铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2),工业中得到较纯氧化铝的过程如下图所示:
试回答下列问题:
(1)操作Ⅰ是一种重要的混合物分离方法,实验室进行该项操作用到的玻璃仪器有烧杯、________、________。
(2)经分析不溶物A的主要成分为________。
(3)工业上电解冶炼铝的化学方程式为________________,若电路中通过1 mol电子,可以得到铝________g。
(4)为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示: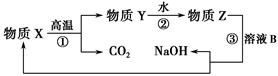
①上述转化中未涉及四种基本反应类型中的________反应;
②写出过程③的化学方程式:____________。
(5)科学研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
下图是一个化学过程的示意图,回答下列问题:
(1)甲池是装置,电极A的名称是。
(2)甲装置中通入CH4的电极反应式为,乙装置中B(Ag)的电极反应式为,丙装置中D极的产物是(写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH =__________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。
若要使丙池恢复电解前的状态,应向丙池中通入(写化学式)。
研究化学反应中的能量变化有重要意义。请根据学过知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:
①反应的热化学方程式为____________________________________________。
②已知:

则

(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1; N-H键的键能是391.55 kJ·mol-1。则1/2N2(g) + 3/2H2(g) ="=" NH3(g)ΔH =。
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
| 实验序号 |
待测液体积(mL) |
所消耗NaOH标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.54 |
| 2 |
20.00 |
6.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.36 |
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点。
(2)盐酸的物质的量浓度为_____________
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是(填“偏高”或“偏低”或“无影响”,下同)。
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在中(填“甲”或“乙”),该反应的离子方程式为:。
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):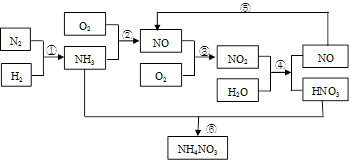
(1)反应④的化学方程式为3NO2+H2O = 2HNO3+NO,该反应的氧化剂为__________,还原剂为__________。
(2)补充并配平反应②的化学方程式:____NH3 +___O2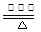 ____NO+ ________
____NO+ ________
(3)化学反应_______(填序号)是非氧化还原反应,离子方程式为_________________
(4)有人设计了一个反应来制备硝酸NO2+NH3 — HNO3+H2O(未配平),你认为该反应(填“能”或“不能”)发生,理由是______________________。
完成以下离子方程式或化学方程式:
(1)实验室制备氯气的离子方程式
(2)实验室制备氢氧化铝的离子方程式
(3)实验室制备氨气的化学方程式
(4)在实验室制备Fe(OH)2的过程中,常会出现白色沉淀迅速变成灰绿色,缓慢变成红褐色的现象。写出这步变化的化学方程式