(7分)海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。下图是某工厂对海水资源综合利用的示意图。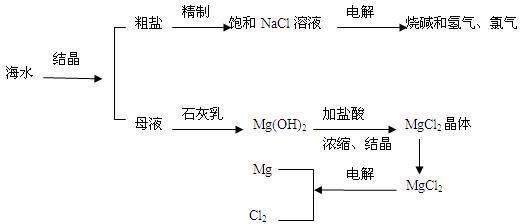
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液。精制时通常向精盐溶液中依次加入过量的BaCl2溶液,过量的NaOH溶液和过量的Na2CO3溶液,过滤出沉淀后再向滤液加入盐酸至溶液呈中性。请写出下列操作中有关化学反应的离子方程式:
①向溶液中加入过量的Na2CO3溶液:__________________、_____________________;
②电解氯化钠溶液:______________________________________________。
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可以看出,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是:(用离子反应方程式回答)___________________________。
②简述怎样操作才能由氯化镁晶体得到无水氯化镁:____________________________。
(4分)写出相对分子质量为128的烃的分子式:________、________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)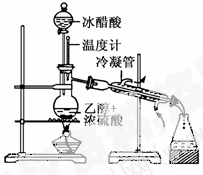
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_________________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:__________________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?________,原因是__________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。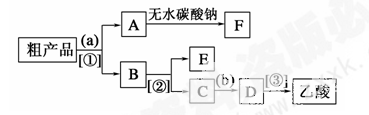
试剂a是__________,试剂b是__________;分离方法①是________,分离方法②是________,分离方法③是______。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系: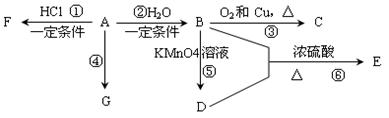
请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→的反应方程式为: _________________,该反应类型是_______________;
(3)G是一种高分子化合物,其链节是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:________________________________,决定F能用于冷冻麻醉应急处理的性质是___________________。
(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性(填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱。
(4)请写出下列物质的电子式。H2OCO2。
有下列各组物质:
A O2和O3(臭氧)B 和
和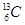
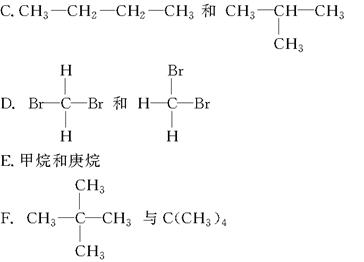
G.CH3COOH与HCOOCH3H.金刚石与石墨
(1)组两种核素互为同位素;(2)组两物质互为同素异形体;
(3)组两物质属于同系物;(4)组两物质互为同分异构体;