现有①CaBr2 ②金刚石 ③ 铜 ④干冰 ⑤Na2SO4 ⑥碘片 ⑦NH4Cl ⑧晶体硅八种物质,按下列要求回答(填序号):
(1)晶体熔化时需 要破坏共价键的是 ,熔点最低的是 。
要破坏共价键的是 ,熔点最低的是 。
(2)属于离子晶体的是 。
(3)晶体中只存在一种微粒间作用力是 。
[化学选修3—物质结构与性质]开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个;
②LiBH4由Li+和BH4-构成,BH4-的等电子体是(写一种).LiBH4中不存在的作用力有____(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 |
I2/KJ•mol-1 |
I3/KJ•mol-1 |
I4/KJ•mol-1 |
I5/KJ•mol-1 |
| 738 |
1451 |
7733 |
10540 |
13630 |
M是______(填元素符号).
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有______种;
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HF_______________________;
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X-定不是________(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为_____。
A.87.5% B.92.9% C.96.3% D.100%
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量不减少,请回答下列问题: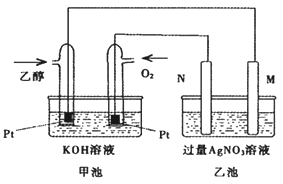
(1)M电极的组成元素在周期表中的位置是_________________,电极名称是__________,加入乙醇的铂电极的电极反应式为________________,写出乙池中发生的化学反应的离子式________________;
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为____________L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为________;
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为________________;
(4)甲烷也是一种很好的清洁能源.蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol.356g“可燃冰”(若分子式为CH4•9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为__________kJ;
海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。
(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
8.1 |
3.8 |
9.5 |
| 完全沉淀pH |
3.7 |
9.6 |
4.8 |
11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。
(1)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。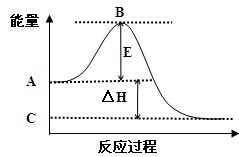 请回答下列问题:
请回答下列问题: ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。 ②图中△H= kJ/mol。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)除去NaCO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(3)用离子方程式表示怎样用化学方法除去下列物质中混有的少量杂质:
①铁粉中混有铝粉
②FeCl2溶液中混有FeCl3
③FeCl3溶液中混有FeCl2
(4)通常用 试剂除去CO2中的HCl气体,反应的离子方程式为 。