氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。

结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 。
0.2molAl2(SO4)3中含有Al3+________mol、SO42-____________个。
填空题。
(1)用以下五种物质的编号进行填空:①甲烷②苯③乙醇④蚁酸⑤淀粉其中:
能发生银镜反应的是 ;燃烧时产生浓烟的是 ;分子结构是正四面体的是 ;
遇碘水显蓝色的是 ;工业上可用乙烯水化法制备得到的是 。
(2)按要求填空:
①葡萄糖的分子式 ; ②乙炔的电子式 ; ③2-甲基-1-戊烯的键线式 。
(3)写出下列反应的化学方程式:
①溴乙烷在氢氧化钠的醇溶液中共热 。
②乙酸乙酯在氢氧化钠的水溶液中共热 。
氯化钠是日常生活的必需品,也是重要的化工原料。粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。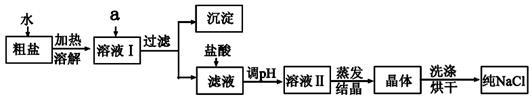
限选试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、_________、________;生成的沉淀含有的成分为泥沙、________。
(2)在滤液中加盐酸发生反应的离子方程式是____________________________________;
(3)对溶液II处理得到晶体时,所必须使用到的玻璃仪器有_________种。
(4)得到的NaCl纯品经测定发现其含有的NaCl与粗盐中NaCl的质量一致,某同学认为此次实验非常成功没有误差,你是否同意他的观点?_______(填“是”或“否”),并给出你的理由_______。
(1)现有下列状态的物质①干冰 ②NaCl晶体 ③氨水 ④铜 ⑤熔融的KOH,其中属于电解质的是 (填序号),属于非电解质的是(填序号),能导电的是 (填序号)。
(2)某有色电解质溶液中,可能大量存在有Ag+ 、H+、Cu2+、OH-、Cl-离子,你认为:一定没有的离子是_________,不能确定的离子 ____________。
使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如下图: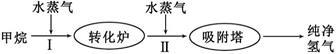
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇。
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)此流程的第I步反应为:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
CO(g) + 3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图。则P1_________P2。(填“<”、“>”或“=”)100℃时,将1 mol CH4和2 mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K=____________。
(3)此流程的第II步反应CO(g) + H2O(g)  CO2(g) + H2(g),
CO2(g) + H2(g),
的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500[ |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:该反应是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为 。
右图表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图中t2时刻发生改变的条件是____(写出一种)。
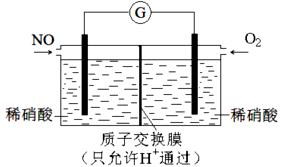
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图,电极为多孔惰性材料。则负极的电极反应式是 。