氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
生成氢氧化物沉淀的pH
| |
Mg(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
9.4 |
6.3 |
1.5 |
| 完全沉淀时 |
12.4 |
8.3 |
2.8 |
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加氨水调节溶液的PH范围为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↓+3CO↑
MgO+S↓+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是 (填化学式)。
②B中盛放的溶液是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硫酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
碘元素的一种核素12553I可用于治疗肿瘤。该核素的质子数为_____________,中子数为__________,质量数为__________,核外电子数为___________.
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 。
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示, 若生成1molN2,计算该过程的△H= kJ·mol-1。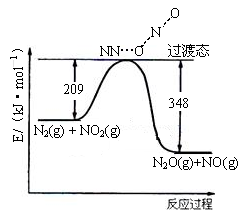
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
① 一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2 起始物质的量浓度为_________mol/L;生成SO3的化学反应速率为__________mol/(L • min)。
②工业制硫酸,尾气SO2用__________吸收。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示: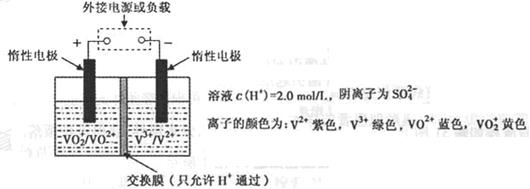
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为 。
狄尔斯和阿尔德在研究1,3-丁二烯的性质时发现如下反应: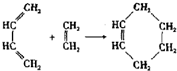 (也可表示为:
(也可表示为: +║→
+║→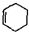 )。回答下列问题:
)。回答下列问题:
(1)狄尔斯-阿尔德反应属于 反应(填反应类型)。
(2)下列具有类似1,3-丁二烯性质的有机物是____________(填写序号);
a. b.
b.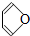 c.
c.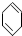 d.
d.
(3)工业上通常以甲醛、乙炔为原料制取1,3-丁二烯,生成流程为: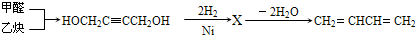
①X的结构简式为____________.
②写出X变成1,3-丁二烯的化学方程式 。
(4)三元乙丙橡胶的一种单体的键线式为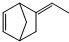 ,它的分子式为 。下列有关它的说法中,不正确的是 。
,它的分子式为 。下列有关它的说法中,不正确的是 。
| A.在催化剂作用下,1mol A可以消耗2mol H2 |
| B.能使酸性KMnO4溶液褪色 |
| C.与等物质的量的Br2发生加成反应,能生成三种有机物 |
| D.分子中含有2个手性碳原子 |
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g) K1∆H < 0 (I)
NaNO3(s) + ClNO(g) K1∆H < 0 (I)
2NO(g) + Cl2(g) 2ClNO(g) K2∆H < 0 (II)
2ClNO(g) K2∆H < 0 (II)
(1)4NO2(g) + 2NaCl(s)  2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 + 2NaOH ="=" NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L‾1的CH3COONa溶液,则两溶液中c(NO3—)、c(NO2—)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10—4mol·L‾1,CH3COOH的电离常数K a=1.7×10—5mol·L‾1),可使溶液A和溶液B的pH相等的方法是 (选填序号)。
| A.向溶液A中加适量水 | B.向溶液A中加适量NaOH |
| C.向溶液B中加适量水 | D.向溶液B中加适量NaOH |