如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜。


(1)甲池中盛有CuSO4溶液,反应一段时间后,有红色物质析出的是 棒,甲池中铁电极上电极反应式是 。
(2)乙池中盛有饱和NaCl溶液,总反应的化学方程式为 。若往乙池中滴入酚酞试液, 电极(填“Fe”或“C”)附近呈现红色。反应一段时间后,若要使溶液恢复到电解前的状态,可以向溶液中通入一定量的 。
(3)丙池中粗铜电极发生 (填“氧化”或“还原”)反应,反应过程中,Cu2+的浓度 (填“增大”、“减小”或“不变”)。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |

回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法_____________________。
(2)加入少量NaHCO3的目的是调节pH在_________________范围内。
(3)反应Ⅱ中加入NaNO2的目的是__________________。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为_________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_______________。
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素总含量为g/L。若滴定前溶液中H2O2没除尽,所测定的铁元素的含量将会____________(填“偏高”“偏低”“不变”)。
查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是_______________(填序号)。
A.测定这两种溶液的pH B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI-淀粉溶液来区别 D.分别在两种溶液中滴加甲基橙
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是_____________(填序号)。
A.Cl2 B.H2O2 C.KMnO4 D.HNO3
(3)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:________________。
(4)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是______________。
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)。
(3)已知在稀盐酸酸化条件下1molNa2Cr2O7能氧化KI生成3molI2,则还原产物为 (填化学式)。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________________;A、B、C的电负性由大到小的顺序为___________;(均用“<”或“>”连接)
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为____________。
(4)E的价层电子排布式是____________,在形成化合物时它的最高化合价为_____________,ECl3形成的配合物的化学式为________________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________。
纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断。上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法)。并在天津建造了我国独立研发的第一家制碱厂。其制碱原理的流程如图所示: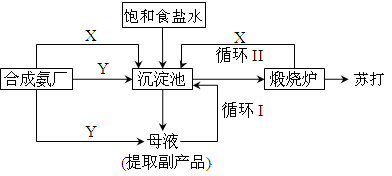
(1)侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明)_____________、______________。
(2)侯氏制碱法的最终产物是(化学式)_______________;其在水溶液中显著的实质是(离子方程式):__________________。
(3)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是:______________、_____________。这两种气体在使用过程中是否需要考虑添加的顺序?____________(填“是”或“否”),原因是_______________。
(4)在沉淀池中发生的反应的化学方程式是_________________。
(5)使原料水中溶质的利用率从70%提高到90%以上,主要是设计了_____________(填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是______________(举一例)。