组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]= 。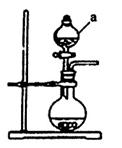
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。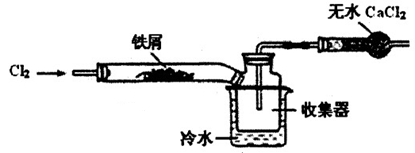
①下列操作步骤的正确排序为 (填字母)。
| A.体系冷却后,停止通入Cl2 |
| B.通入干燥的Cl2赶尽装置中的空气 |
| C.在铁屑下方加热至反应完成 |
| D.用干燥的H2赶尽Cl2 |
E.检验装置的气密性
②该实验装置存在的明显缺陷是 。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O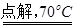 NaClO3+3H2
NaClO3+3H2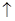 ,
,
2NaClO3+4HCl=2C1O2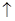 +Cl2
+Cl2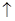 +2NaCl+2H2O。
+2NaCl+2H2O。
有关物质性质:
| 物质 |
熔点/℃ |
沸点/℃ |
| C1O2 |
-59 |
11 |
| Cl2 |
-107 |
-34.6 |
ClO2的生产流程示意图: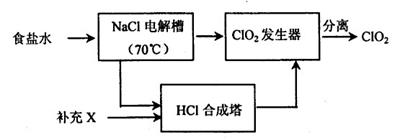
该工艺中,需要补充的物质X为 (填化学式),能参与循环的物质是 (填化学式)。从ClO2发生器中分离出ClO2可采用的方法是 。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)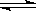 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)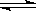 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________________________。
(1)①根据下列图示,写出反应的热化学方程式___________________________。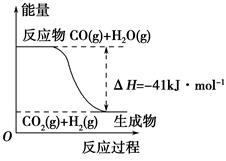
②根据如图所示情况,判断下列说法中正确的是________。
| A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ·mol-1 |
| B.该反应为吸热反应 |
| C.该反应为放热反应 |
| D.当H2O为液态时,其反应热值小于41 kJ·mol-1 |
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是________________________________________。
(3)如图是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为_________________________________。
a、b两条曲线产生区别的原因很可能是_________________________________。
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。
反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是__________________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+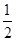 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。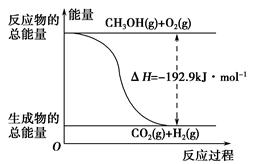
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+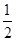 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
为保护环境并缓解能源危机,专家提出利用太阳能促使燃烧循环使用的构想,转化关系如图所示。
已知:
(1)过程Ⅰ可用如下反应表示:①2CO2 2CO+O2
2CO+O2
②2H2O(g) 2H2+O2
2H2+O2
③2N2+6H2O 4NH3+3O2
4NH3+3O2
④2CO2+4H2O 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+4H2O ________+3O2。
________+3O2。
(2)25 ℃时,a g CH4完全燃烧释放出b kJ热量。下列说法不正确的是( )。
| A.过程Ⅰ是将太阳能转化成化学能 |
| B.反应⑤的另一种产物为CH4 |
| C.ΔH1=-ΔH2 |
| D.表示甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16b kJ·mol-1 |
短周期元素X、Y、Z、W的原子序数依次增大。X的氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与主族序数相等;Z的单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。
请回答下列问题:
(1)Y在元素周期表中的位置是________;X的氢化物的电子式是________。
(2)X的氢化物的水溶液与W的氢化物的水溶液混合后恰好反应时,溶液呈________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因:____________________。
(3)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
(4)含Y的两种盐溶液混合产生白色沉淀,写出反应的离子方程式:______________________________________________________。
(5)X、Z、W的最高价氧化物对应的水化物的酸性强弱顺序为________(用化学式表示,下同);Z、W的简单气态氢化物的还原性强弱顺序为________;X、Z、W的最简单氢化物中,沸点最高的是________。