某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下: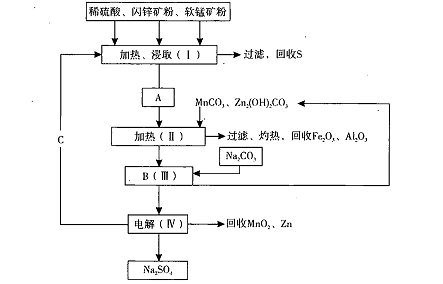
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O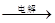 MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是 。
(2)加入MnCO3、Zn2(OH)2CO3的作用是 :C的化学式是 。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是 。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式 。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、 、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是 。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100gl0.00%的K2SO4溶液,电极均为石墨电极。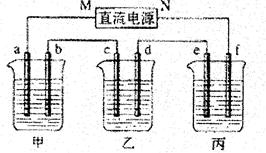
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积: ;
;
④电极c的质量变化是g;
⑤电解前后个溶液的酸,碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
某溶液中含有K+、NH+4、Al3+、OH-、AlO-2、SO2-4、CO2-3、SiO2-3、Cl-等离子中的某几种。现进行如下实验:①取少量溶液逐滴加入盐酸,先无明显现象,当盐酸加到一定体积后开始产生沉淀并逐渐增多,在沉浣不再增加后又产生一种无色气体,在气体不再产生后沉淀开始溶解,直至最后完全消失;
②取①所得溶液,加入Ba(OH)2溶液,无明显现象。
(1)原溶液中肯定存在的离子是;肯定不存在的离子是。
(2)已知用一定体积的原溶液进行实验①时,需消耗0.2 mol/L的盐酸5 mL,这时向所得溶液中加入足量的硝酸银溶液可得沉淀0.187g,则原溶液中(填“有”“没有”或“不确定”)Cl-。
现有A、B、C、D四种金属,若将A和B用导线相连,浸入稀硫酸中,A上有气泡产生;若将D放入B的硝酸盐溶液中,D表面有B析出;若在含有A和C两种离子的盐溶液中进行电解,阴极上有C析出。试判断,这四种金属还原性递减的顺序是,若四种金属之一是铜,铜可能是,不 可能是。
可能是。
已知甲烷的燃烧热为890.3 kJ/mol请完成表示甲烷燃烧的热化学方程式
硫酸铜晶体里结晶水的测定实验中,首先应将晶体放在____中研碎,晶体应在中加热,冷却时应将其放在中进行,如果不这样冷却则实验结果会(填“偏高”或“偏低”或“无影响”)。此实验至少量次。