已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按图进行反应。
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是_______________________________________________。
(3)如果E溶液是一种强酸,则E的化学式为__________________________。
已知1 molCO气体完全燃烧生成CO2 气体放出283 kJ热量;1 mol氢气完全燃烧生成液态水放出286 kJ热量;1 molCH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)若1 molCH4气体完全燃烧生成CO2气体和水蒸气,放出热量为890 kJ(填“>”、 “<”、“= ”)。
(2)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水时,则放出热量(Q)的 取值范围是。
取值范围是。
(3)若将a molCH4、CO和H2的混合气体完全燃烧,生成 CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是___________________________。
聚苯乙烯可用于制备高频绝缘材料,苯乙 烯在一定条件下存在如下图转化关系。
烯在一定条件下存在如下图转化关系。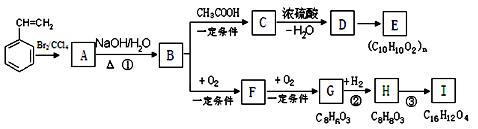
请回答下列问题:
(1)由苯乙烯合成这种高聚物的化学方程式为。
(2)反应①的反应类型是,C→D的反应类型是。
(3)C可能的结构简式有。
(4)H有多种同分异构体。同时符合下列条件的同分异构体共有种。
a. 与FeCl3溶液发生显色反应 b. 1 mol H最多能与3 mol NaOH反应;
c. 苯环上只有两个取代基。
(5)反应③的化学方程式是。
(10分)钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:___________________________________。
(2)下列各个装置中铁棒被腐蚀由难到易的顺序是_______________(填字母)。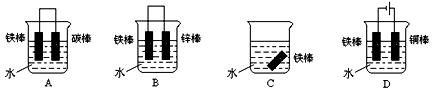
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图,请回答:
① A电极的电极反应式是 __
②若电镀前铁、铜两电极的质量相同,电镀完成后, 若电镀时
电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差____g。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
下列各化合物中,属于同系物的是(填入编号),属于同分异构体的是(填入编号)。

(1)有机物含有的官能团不同,性质也有差异。
①1mol下列有机物可与2mol溴单质发生加成反应的是 ▲(填字母)。
A.乙烯 B.乙炔C.乙烷
②下列有机物中,核磁共振氢谱只有一个吸收峰的是 ▲(填字母)。
A.苯B.苯酚C.苯甲酸
③下列有机物中,能发生银镜反应的是 ▲(填字母)。
A.乙酸乙酯 B.乙醇C.葡萄糖
(2)分子式为C4H10O,属于醇的同分异构体有 ▲种,其中一种不能氧化成醛或酮,它的结构简式是 ▲;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式 ▲。
(3)科学家常采用将药物连接在高分子载体上,制成缓释长效药物。已知某种解热镇痛类药物,其结构简式为A,把它连接到高分子聚合物B上,形成缓释长效药物C。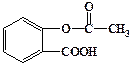

A C
①高分子聚合物B的结构简式为 ▲。
②A与B反应生成C的反应类型是 ▲。
③A可水解成 ▲和 ▲(写结构简式)。