由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 |
实验内容 |
实验结果 |
| 1 |
加过量盐酸 |
无气体产生 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 |
第一次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对CO32-是否存在的判断是________,(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L-1) |
| |
|
| |
|
| |
|
C、S、O、Se是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为








(2)C、Si、Sa三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SO2晶体的空间构型及硅氧之间的成键方式 ; ③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
(4)CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-3,CO分子中碳氧键的伸缩振动频率为2143cm-2,则Ni(CO)中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A.强
B.弱
C.相等
D.无法判断
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
A、B、C、D、E代表5种元素。请填空:








(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
第三周期中的半导体材料 |
| B |
L层s电子数比p电子数少1 |
| C |
第三周期主族元素中其第一电离能最大 |
| D |
前四周期呀中其未成对电子数最多 |
(1)B单质分子中,含有________个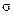 键和__________个
键和__________个 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。