新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶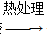 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4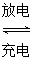 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g) + O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
E、加入催化剂 G、移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是。
酸雨的形成主要是由于空气中含有气体。现取一份雨水,每隔一段时间测定其pH,结果如下:
| 测定时间/h |
0 |
1 |
2 |
4 |
8 |
| 雨水pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
产生上述结果的原因是。
工业上用接触法制取硫酸过程中,硫铁矿在沸腾炉中燃烧的化学方程式是,该反应中氧化剂是______,还原剂是______,被氧化的元素是______,被还原的元素是______。
你认为减少酸雨产生的途径可采取的措施是:①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源(填写标号)______。
四川有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):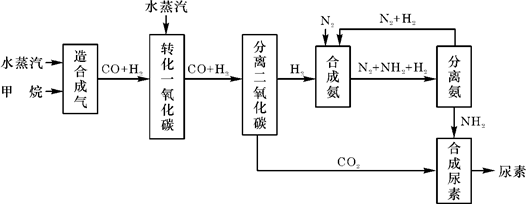
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: _____________
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中即使分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请应用化学反应速率和化学平衡的观点说明采取该措施的理由: _____________________
(3)当甲烷合成氨气的转化率为75%时,以5.60×107 L甲烷为原料能够合成L 氨气。(假设体积均在标准状况下测定)
(4)已知尿素的结构简式为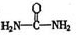 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①,②。
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①,②。