同学们在学习了酸碱盐的性质后,萌生了用身边的物质来制取新物质并研究物质性质的想法。请你参与其中,体验实验探究的快乐吧。
【粗产品制备】
课外化学兴趣小组的同学利用家里的纯碱溶液和贝壳为原料制备烧碱,按图所示流程进行实验,请你参与讨论并回答相关问题。
(1)贝壳高温煅烧时,发生反应的化学方程式是 ;
(2)操作Ⅰ是____________,该过程中用到的玻璃仪器有烧杯、 、玻璃棒;
(3)得到烧碱时发生反应的化学方程式为 ;
(4)得到的溶液存放在如图所示的 的瓶中(填A 或B)。
【粗产品成分分析】
将溶液蒸发结晶得到固体C,固体C中的成分有哪些呢?
甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH) 2 Na2CO3; 丁认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 ;
(5)甲取少量固体C,加水溶解,向其中滴加3滴酚酞试剂,溶液变为红色,立即得出结论甲的说法正确,你认为甲的结论 (填“正确”、“错误”或“无法确定”),理由是 ;
(6)丁取适量固体C溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ;结论:由上述实验,你认为__________同学的实验结论是正确。
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要虑 。
【定量分析】
(7)另称取10g上述样品C,放入盛有100g7.3%的稀盐酸的烧杯中,恰好完全反应,反应后将所得溶液蒸发,求得到的氯化钠固体质量(写出过程2分)。
美美同学在开展研究性学习时,做了一个有关物质溶解和物质发生化学反应过程中能量变化的探究实验,装置如下图所示。小试管A、B中分别盛有两种不用的无色液体,U型管内均为品红溶液。
(1)若试管A中的无色液体是水,向试管A中加入适量烧碱,则U型管的a、b两端液面的变化是:b端液面______________(填“升高”、“降低”或“不变”,)产生此现象的原因是___________________。
(2)若试管B中的无色液体是稀硫酸,向B试管中加入镁条,看到试管中产生大量无色气泡,且U型管a、b两端液面的变化与(1)相同,则产生此现象原因是__________。
(3)通过本实验的探究,再结合所学知识,我们可以得出结论是____________________。
现有失去标签的三瓶无色液体,分别是澄清石灰水、稀硫酸和蒸馏水,请用一种试剂一次将三瓶物质鉴别出来。
(1)写出两种鉴别的方法(只写试剂名称)_____________、____________。
(2)简述其中的一种鉴别方法(包括步骤、现象及结论)。
长途运输鱼苗时,常在水中加入少量过氧化钙(CaO2)固体。甲、乙两位同学发现往水中投入过氧化钙时产生气泡。
【提出问题】当把过氧化钙投入足量水中时,最终生成什么物质?
【进行猜想】甲同学:生成氧化钙和氧气;乙同学:生成氢氧化钙和氧气。
你赞同的猜想是(填“甲”或“乙”),其理由是;
【实验探究】
(1)打开右图装置中分液漏斗的活塞,控制滴加水速度,观察到
试管内有气泡产生。
①(填实验操作),
说明生成的气体是氧气。
②实验过程中,发现烧杯中有气泡出现,该现象说明。
(2)请设计一个实验方案来验证乙同学猜想的生成物中有“氢氧化钙”:
| 实验步骤及操作方法 |
预期的实验现象 |
结论 |
| ①取少量过氧化钙放入试管中,加足量水,振荡, ②。 |
①产生气泡, ②。 |
过氧化钙和水反应产生的另一种物质是氢氧化钙 |
【问题讨论】
(1)运输鱼苗时,在水中加入少量过氧化钙的主要目的是;
(2)过氧化钙和水反应的化学方程式为。
实验室利用下列装置可以制取某些气体,请据图回答问题:
(1)这五个装置示意图中,有一个装置是错误的,指出错误装置是(填序号)。
(2)图示中仪器①的作用;实验室用高锰酸钾来制取氧气,可选择A作发生装置,但要对A进行改进,改进的方法是;实验室若用B作发生装置制氧气,则该反应方程式为。
(3)常温下,硫化氢(H2S)是一种有臭鸡蛋气味的气体,实验室可用硫化亚铁(FeS)固体和稀硫酸反应制得,该反应方程式为FeS + H2SO4(稀)= H2S↑+Fe SO4,则应选择
(填序号,下同)来作发生装置。
(4)NO气体难溶于水,密度略大于空气,易与氧气反应生成NO2,则应选择装置来收集NO。
如右图所示:水槽内盛有澄清石灰水,点燃高低两支蜡烛,用钟罩将其扣在水槽内。一段时间后可以观察到的现象有:①钟罩内澄清的石灰水变浑浊;②;③。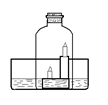
现象①用化学方程式可表示为;现象②和③出现的原因是、。
④某同学用上述实验来测定空气中氧气的体积含量,结果发现与理论数据有偏差,其原因可能是。(提示:本装置气密性良好)