现有一瓶甲、乙的混合物,已知甲、乙属同系物,甲、乙某些性质如下:
| 物质 |
分子式 |
熔点(℃) |
沸点(℃) |
密度(g/cm3) |
水溶性 |
| 甲 |
C3H6O2 |
-98 |
55.5 |
0.93 |
可溶 |
| 乙 |
C4H8O2 |
-84 |
87 |
0.90 |
可溶 |
根据物理性质,将混合物中甲、乙分离的最佳方法是( )
A.蒸馏 B.萃取 C.重结晶 D.分液
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.标准状况下,2.24 L C6H14中含有极性共价键的数目为1.4 NA |
| B.0.1 mol·L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA |
| C.100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA |
| D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含氢原子的数目为2 NA |
下列离子方程式正确的是
| A.氨水与亚硫酸溶液混合:NH3·H2O+H+===NH4++H2O |
| B.将少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO- =" 2HClO" +CaSO3↓ |
| C.足量铁屑溶于稀硫酸:2Fe+6H+= 2Fe3++3H2↑ |
| D.将Cl2通入FeSO4溶液中:Cl2+2Fe2+==2Fe3++2Cl- |
下列有关化学用语表示正确的是
A.18O2- 结构示意图: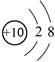 |
B.Na2O2的电子式: |
C.HCO3-的水解方程式HCO3- +H2O  H2CO3+OH- H2CO3+OH- |
D.HI的电离方程式 HI  H++I- H++I- |
化学与社会、生产、生活密切相关。下列说法不正确的是
| A.信息产业中光纤的主要成分是单质硅 |
| B.碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 |
| C.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| D.医学上,血液透析是利用了胶体的渗析原理 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |