硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3−=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
b.2c(Na+)=c(H2S)+c(HS−)+c(S2−)
c.c(Na+)=3[c(H2S)+c(HS−)+c(S2−)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为 。
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学方程式是 。
(14分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B,D。
(2)画出C元素的离子结构示意图。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物为,所含的化 学键类型为。
学键类型为。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为(用离子符号表示)。
Ⅰ用元素符号或化学式回答原子序数11~18的元素的有关问题:
(1)除稀有气体外,原子半径最大的元素是________________;
(2)最高价氧化物对应水化物呈两性的元素是________________;
(3)最高正 价氧化物对应水化物酸性最强的酸是________________;
价氧化物对应水化物酸性最强的酸是________________;
(4)能形成气态氢化物且氢化物最稳定的元素是____ ____________。
____________。
Ⅱ在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,则溶液中n(Mg2+):n(Al3+)= ,AB段发生的离子反应为。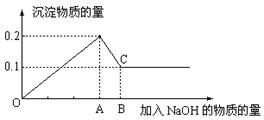
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,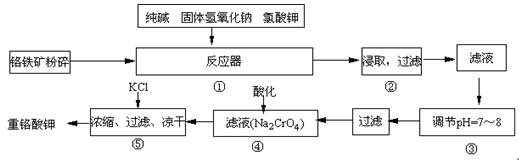
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)操作③的目的是什么,用简要的文字说明:
。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定。
(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)%(保留小数点后两位)。
(15分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) ="=" Cu2+(aq) + H2(g)△H= +64.39kJ/mol
2H2O2(l) ="=" 2H2O(l) + O2 (g)△H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)="=" H2O(l)△H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围,向反应后溶液中加入4mol/L NaOH溶液ml,沉淀质量达到最 大
大 值。
值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67 .2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量g。(用含a的代数式表示)
.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量g。(用含a的代数式表示)
水处理技术在工业生产和日常生活中有着重要应用。
(1)水处理絮凝剂包括无机絮凝剂和有机絮凝剂。无机絮凝剂如明矾,其原理用离子方程式表示为;有机絮凝剂如聚丙烯酸钠。 (2)氯气进行自来水消毒时,起消毒杀菌作用的物质是(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是。
(2)氯气进行自来水消毒时,起消毒杀菌作用的物质是(写化学式),但用氯气消毒的水可能有臭味,长期饮用还可能对人造成潜在危害;ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,工业上可用SO2与NaClO3溶液反应制得,该反应离子方程是。
(3)高铁酸钠(Na2FeO4)作为水处理剂兼具絮凝剂和消毒杀菌剂的作用,被科学家们公认为绿色消毒剂。Na2FeO 4用于消毒杀菌,是利用其性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是。
4用于消毒杀菌,是利用其性;实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制备高铁酸钠的稀溶液,该反应的离子方程式是。